Амфотерные металлы и неметаллы - это класс веществ, которые могут проявлять кислотные и основные свойства. Такой химический характер позволяет им реагировать с различными веществами и принимать участие в различных химических процессах.
В отличие от других металлов и неметаллов, амфотерные элементы могут реагировать как с кислотами, так и с основаниями. Они могут образовывать как соли с кислотами, так и соли с основаниями. Например, такими амфотерными металлами являются алюминий и цинк, а амфотерными неметаллами - германий и антимон.
Свойства амфотерных металлов и неметаллов обусловлены структурой и составом их электронных оболочек. Однако, у металлов эти свойства обусловлены способностью отдавать электроны при взаимодействии с кислотами и основаниями, а у неметаллов - способностью принимать электроны.
Особенностью амфотерных металлов и неметаллов является то, что они могут вести себя как ионизированные частицы в растворах, так и нейтральные молекулы при взаимодействии с другими веществами. Это отличает их от других элементов и придает им уникальные химические свойства.
Таким образом, свойства амфотерных металлов и неметаллов позволяют им быть чрезвычайно гибкими в химических реакциях. Они способны взаимодействовать с различными веществами и проявлять как кислотные, так и основные свойства, что делает их важными компонентами в различных химических процессах и реакциях.
Амфотерные металлы и неметаллы: различия и общие свойства

Амфотерные металлы и амфотерные неметаллы - это элементы, которые могут проявлять как металлические, так и неметаллические свойства в зависимости от условий окружающей среды.
Одним из главных общих свойств амфотерных металлов и неметаллов является способность реагировать как с кислотами, так и с основаниями. Это свойство объясняется наличием у них подвижных электронов в валентной оболочке.
Однако, металлы и неметаллы отличаются по реакции с кислотами и основаниями. Амфотерные металлы, такие как алюминий, цинк и свинец, реагируют с кислотами, образуя соли и выделяя водород. Они также реагируют с основаниями, образуя соли и выделяя воду.
С другой стороны, амфотерные неметаллы, такие как сера и фосфор, реагируют с щелочами, образуя соли и выделяя воду. Они также реагируют с кислотами, образуя соли и выделяя огонь.
Еще одно общее свойство амфотерных металлов и неметаллов - возможность образования активных оксидов. Активные оксиды реагируют с кислородом и водой, образуя кислоты и основания.
В целом, химические свойства амфотерных металлов и неметаллов связаны с их электронной структурой и способностью принимать и отдавать электроны в реакциях с различными веществами. Это делает амфотерные элементы уникальными и широко используемыми в различных отраслях промышленности и науки.
Химические свойства амфотерных металлов
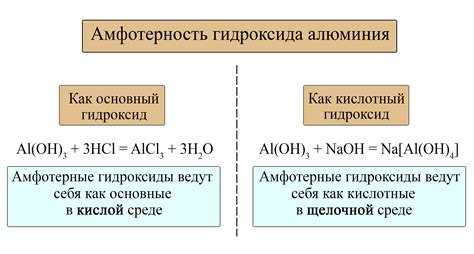
Амфотерные металлы – это класс элементов, обладающих способностью проявлять кислотные и щелочные свойства. То есть они могут реагировать как с кислотными веществами, так и с щелочными. Эти металлы взаимодействуют как с оксидами, так и с гидроксидами.
Одним из самых известных амфотерных металлов является алюминий. Он реагирует с кислотами, образуя соли, и с гидроксидами, образуя основания. Например, алюминий может реагировать с соляной кислотой, образуя алюминий хлорид, или с натриевым гидроксидом, образуя алюминий оксид.
Еще одним примером амфотерного металла является цинк. Он также может реагировать с кислотами и основаниями. Например, цинк может реагировать с серной кислотой, образуя цинк сульфат, или с гидроксидом натрия, образуя цинкат натрия.
Другим амфотерным металлом, не таким известным, является кадмий. Он также проявляет кислотные и щелочные свойства. Кадмий может реагировать с кислотами, образуя соли, и с гидроксидами, образуя основания.
В целом, химические свойства амфотерных металлов обусловлены их способностью образовывать ионы различных зарядов в реакциях с кислотами и щелочами. Это делает эти металлы уникальными и позволяет им проявлять разнообразные свойства в различных химических реакциях.
Химические свойства амфотерных неметаллов

Амфотерные неметаллы - это вещества, которые могут проявлять как кислотные, так и основные свойства в зависимости от условий реакции. Они обладают способностью образовывать соединения с различными элементами и ионами, проявляя при этом разную химическую активность.
Одним из примеров амфотерных неметаллов является водород. Он может образовывать кислоты (например, соляную кислоту) или основания (например, гидроксид натрия). В реакциях с металлами водород может выступать в качестве окислителя или восстановителя.
Кислотные свойства амфотерных неметаллов проявляются в реакциях с основаниями. Например, сера (амфотерный неметалл) взаимодействует с гидроксидом натрия, образуя сульфат натрия и воду. Также амфотерные неметаллы способны образовывать кислотные оксиды, которые реагируют с водой, образуя кислотные растворы.
Основные свойства амфотерных неметаллов проявляются в реакциях с кислотами. Например, сера может реагировать с соляной кислотой, образуя сульфат натрия и воду. Кроме того, амфотерные неметаллы способны образовывать основные оксиды, которые реагируют с водой, образуя щелочные растворы.
Таким образом, амфотерные неметаллы - это вещества, которые могут проявлять как кислотные, так и основные свойства в зависимости от условий реакции. Их химическая активность определяется способностью образовывать соединения с различными элементами и ионами.
Физические свойства амфотерных металлов и неметаллов
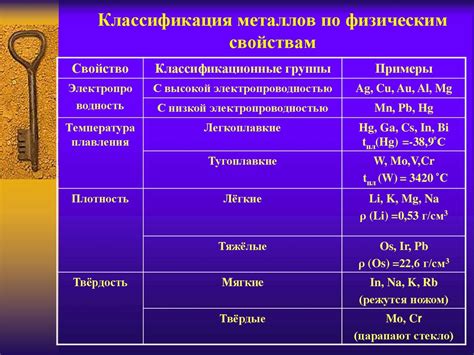
Амфотерные металлы и неметаллы обладают определенными физическими свойствами, которые отличают их от других элементов. Одна из основных характеристик амфотерных металлов и неметаллов - это их способность проявлять кислотные и основные свойства в зависимости от условий окружающей среды.
Амфотерные металлы могут реагировать как с кислотами, так и с основаниями. Например, алюминий (Al) может проявлять кислотные свойства, реагируя с щелочью и образуя соль, а также проявлять основные свойства, реагируя с кислотой и образуя соль и воду.
Неметаллы также могут проявлять амфотерные свойства, например, кислотные свойства хлора (Cl) можно наблюдать при реакции со щелочью, образуя соль, а его основные свойства проявляются при реакции с кислотой, образуя соль и воду.
Кроме того, амфотерные металлы и неметаллы также отличаются температурой плавления и кипения. Некоторые амфотерные металлы, такие как цинк (Zn) и свинец (Pb), обладают низкой температурой плавления, что делает их полезными материалами для различных промышленных процессов. Неметаллы, например, сера (S) и фосфор (P), имеют относительно низкую температуру плавления и кипения, что также делает их важными в различных отраслях промышленности.
Таблица ниже представляет некоторые примеры амфотерных металлов и неметаллов:
| Амфотерные металлы | Амфотерные неметаллы |
|---|---|
| Алюминий (Al) | Хлор (Cl) |
| Цинк (Zn) | Фосфор (P) |
| Свинец (Pb) | Сера (S) |
| Бериллий (Be) | Бор (B) |
Таким образом, физические свойства амфотерных металлов и неметаллов включают их способность проявлять кислотные и основные свойства, а также различия в температуре плавления и кипения.
Вопрос-ответ

Что такое амфотерные металлы и неметаллы и как они отличаются?
Амфотерные металлы и неметаллы - это вещества, которые могут проявлять как кислотные, так и щелочные свойства в зависимости от среды. Основное отличие между ними заключается в ионизации в растворе: металлы образуют положительные ионы (катионы), а неметаллы - отрицательные (анионы).
Какие металлы являются амфотерными и почему?
К амфотерным металлам относятся алюминий, цинк, свинец, железо. Они обладают способностью образовывать как катионы, так и анионы в соответствующих условиях. Это связано с тем, что у амфотерных металлов в своей электронной оболочке имеется несколько уровней энергии, на которые могут переходить электроны.
Какие неметаллы являются амфотерными и какова их роль в природе?
Амфотерные неметаллы включают группу галогенов (хлор, бром, йод) и оксиген. Они могут образовывать как катионы, так и анионы в различных реакциях. Роль амфотерных неметаллов в природе заключается, например, в возможности образования солей и кислот, которые играют важную роль в многих биологических процессах и реакциях.
