Металлы - это класс веществ, обладающих такими свойствами, как блеск, теплопроводность и электропроводность. Одним из ключевых аспектов, определяющих эти свойства, является структура металлических атомов.
Металлические атомы отличаются своей упаковкой в кристаллической решетке. Обычно они образуют кубическую или гексагональную кристаллическую структуру. В такой решетке металлические атомы располагаются близко друг к другу, образуя регулярные слои или ряды.
Свойства металлов также определяются электронной структурой атома. Металлические атомы имеют небольшое количество электронов в своей валентной оболочке, что позволяет им образовывать свободные электроны, свободно движущиеся внутри металла. Эти свободные электроны отвечают за электропроводность и теплопроводность металлов.
Именно свободные электроны отвечают за электропроводность металлов. Они могут перемещаться под действием электрического поля и создавать электрический ток. Теплопроводность металлов объясняется свободным движением электронов: они переносят тепло от области с более высокой температурой к области с более низкой температурой.
Структура и свойства металлических атомов играют ключевую роль в их промышленном и научном применении. Изучение этих свойств помогает в разработке новых материалов с желаемыми свойствами в различных областях, таких как электроника, авиация и строительство.
Основные элементы металлических атомов
Металлические атомы отличаются от атомов других элементов своими особыми свойствами и структурой. Они являются основными строительными блоками металлических материалов и обладают рядом характеристик, которые делают металлы полезными для различных промышленных и технических целей.
Основными элементами металлических атомов являются ядро и электронная оболочка. Ядро представляет собой сжатое и тяжелое ядро из протонов и нейтронов, которые обуславливают массу атома и его заряд. Электронная оболочка состоит из электронов, которые обращаются по орбитам вокруг ядра и создают электрический заряд металлического атома.
Взаимодействие и взаимное расположение этих элементов определяет многие свойства металлов, такие как электропроводность, теплопроводность, пластичность и твердость. Количество электронов в внешней оболочке и их энергетический уровень влияют на химическую активность металлического атома и его способность образовывать химические связи с другими атомами.
Кроме того, металлические атомы могут образовывать кристаллическую решетку, в которой атомы упорядочены по определенным правилам. Это способствует уникальным механическим и физическим свойствам металлов, таким как высокая прочность, эластичность и способность сохранять форму.
В целом, понимание структуры и свойств металлических атомов является ключевым для развития новых материалов и улучшения их технологических характеристик. Изучение этих элементов позволяет нам лучше понять, как происходят различные физические и химические процессы в металлических материалах и как использовать их в практических приложениях.
Электронная оболочка
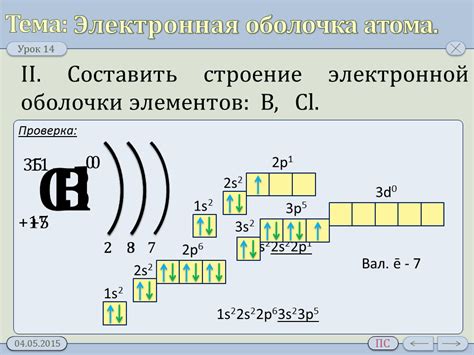
Электронная оболочка - внешняя граница атома, которая содержит электроны. Она состоит из нескольких энергетических уровней или слоев. На этих уровнях электроны распределяются по подуровням и орбиталям.
Каждая электронная оболочка характеризуется главным квантовым числом (n), которое определяет энергию уровня и его размер. Чем выше главное квантовое число, тем дальше электронная оболочка от ядра и больше электронов может вмещать.
На каждом энергетическом уровне находится несколько подуровней, которые обозначаются буквами s, p, d, f. Каждый подуровень имеет разный максимальный размер и форму. Например, подуровень s может вместить максимум 2 электрона, а подуровень p - 6 электронов.
Орбитали находятся внутри каждого подуровня и характеризуются формой и ориентацией в пространстве. На каждой орбитали может находиться максимум 2 электрона с противоположными спинами.
Распределение электронов по электронной оболочке описывается электронной конфигурацией. Она показывает количество электронов на каждом энергетическом уровне, подуровне и орбитали.
Физические свойства металлических атомов

1. Проводимость электричества и тепла. Одним из характерных свойств металлических атомов является их способность проводить электрический ток и тепло. Это связано с наличием свободных электронов в оболочках атомов, которые могут свободно перемещаться в металлической решетке и переносить электрический заряд и тепловую энергию.
2. Гибкость и пластичность. Металлы обладают высокой степенью гибкости и пластичности, что позволяет им быть легко деформируемыми без разрушения. Под воздействием силы металлические атомы могут смещаться относительно друг друга, что позволяет материалу сохранять свою форму даже после сильных деформаций.
3. Магнитные свойства. Некоторые металлы обладают магнитными свойствами. Это связано с наличием у атомов металла незаполненных электронных оболочек и наличием спинового магнетизма. Магнитные металлы могут образовывать постоянные магниты или быть притянутыми к магнитному полю.
4. Плотность и тяжесть. Металлы обладают высокой плотностью и тяжестью. Это связано с компактной упаковкой атомов в металлической решетке и большой массой каждого атома. Поэтому металлы обладают высокой удельной массой и являются тяжелыми материалами.
5. Оптические свойства. Некоторые металлы обладают особыми оптическими свойствами. Например, золото имеет желтый цвет, а медь - красную. Цвет металлов связан с электронной структурой атомов и способностью поглощать и рассеивать свет разных длин волн.
В целом, физические свойства металлических атомов определяют их уникальные характеристики и широкое применение в различных областях, включая промышленность, электронику, строительство и другие отрасли.
Проводимость электричества

Проводимость электричества - это свойство материалов вещества, позволяющее передвижение электрических зарядов внутри них. Оно зависит от структуры и свойств металлических атомов.
В металлах проводимость электричества обеспечивается наличием свободных электронов. В кристаллической решетке металла атомы располагаются близко друг к другу и образуют плотную структуру. Однако, часть электронов в металлическом связана с атомами и не может свободно двигаться.
Свободные электроны - это электроны, которые слабо связаны с атомами и свободно передвигаются по металлу. Они образуют электронное облако вокруг атомов. Благодаря свободным электронам, металлы обладают высокой проводимостью электричества.
Проводимость электричества в металлах основана на физической особенности свободных электронов - их способности свободно двигаться под воздействием электрического поля. Под действием электрического поля, электроны начинают перемещаться вдоль металлической решетки от одного атома к другому. Таким образом, металлы становятся хорошими проводниками электричества.
В результате проводимость электричества в металлах достигает очень высоких значений и они широко используются в электротехнике, электронике и других областях, где требуется эффективное протекание электрического тока.
Вопрос-ответ

Что такое металлический атом?
Металлический атом - это атом химического элемента, который обладает свойствами металла. Он характеризуется наличием свободных электронов во внешней оболочке и образованием кристаллической решетки при формировании металлического соединения.
Какова структура металлических атомов?
Структура металлических атомов характеризуется наличием ядра, вокруг которого движутся электроны. В металлах электроны находятся в свободном состоянии и образуют так называемый "электронный облак". Это облако создает электронную оболочку, которая фактически не имеет четкой формы и может быть описана как море свободных электронов. Металлические атомы могут объединяться в кристаллическую решетку, образуя металлическую структуру.
