Щелочные металлы являются одной из самых распространенных групп элементов в периодической системе химических элементов. В их состав входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе элементов и обладают сходными химическими свойствами.
Строение простых веществ щелочных металлов в значительной степени определяется присутствием в их электронной оболочке только одного электрона валентной оболочки. Это делает их очень реакционноспособными, особенно в контакте с водой, поскольку они способны легко отдать этот электрон.
Щелочные металлы образуют катионы с однозарядным ионом, который они образуют при окислении. Этот ион обладает положительным зарядом и химическая реакционность щелочных металлов основана на этой особенности.
Благодаря своей реакционности, щелочные металлы широко используются в различных областях: от производства широкого спектра химических соединений до производства алкалийных батарей и лекарственных препаратов. Изучение строения этих простых веществ позволяет лучше понять их особенности и свойства и использовать их в различных областях науки и техники.
Структура щелочных металлов: особенности и свойства

Строение щелочных металлов обладает рядом особенностей, отличающих их от других классов элементов. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют простую кристаллическую структуру. Она представляет собой компактные структуры, где атомы щелочных металлов расположены в регулярной кристаллической решетке.
Основным свойством структуры щелочных металлов является их высокая металлическая проводимость. Это связано с хорошей подвижностью свободных электронов, которые образуют так называемое "море электронов". Такая структура способствует электрической проводимости материала, что делает щелочные металлы одними из самых эффективных проводников электричества.
Еще одной особенностью структуры щелочных металлов является их низкая плотность. В кристаллической решетке атомы щелочных металлов занимают небольшой объем, что приводит к малой плотности материала. Это делает щелочные металлы легкими и легко обрабатываемыми.
Структура щелочных металлов также определяет их химическую реактивность. Из-за низкой энергии ионизации и большего радиуса атомов, щелочные металлы вступают в реакции с различными веществами, включая воду и кислород. Это приводит к образованию гидроксидов и оксидов соответствующих щелочных металлов.
В целом, структура щелочных металлов определяет их основные свойства, такие как металлическая проводимость, низкая плотность и химическая реактивность. Эти свойства делают щелочные металлы важными и широко используемыми в различных областях науки и промышленности.
Основные свойства щелочных металлов

1. Щелочные металлы обладают высокой реактивностью: они способны вступать в реакцию с водой, кислородом и другими веществами. Их реактивность обусловлена наличием одной валентной электронной оболочки, что делает их нестабильными.
2. Щелочные металлы образуют ионы с положительным зарядом: они готовы отдать свой валентный электрон, образуя ионы с положительным зарядом. Это свойство делает их реактивными и способными вступать в реакцию с отрицательно заряженными частицами.
3. Щелочные металлы хорошо растворяются в воде: они образуют щелочные растворы, в которых присутствуют гидроксид и гидроксион ионы. Растворы щелочных металлов обладают высокой щелочностью и способны проявлять жирорастворяющие свойства.
4. Щелочные металлы обладают низкой плотностью: их плотность является одной из самых низких среди металлов. Это связано с их структурой и наличием большого объема вакантных мест в кристаллической решетке.
5. Щелочные металлы обладают низкой температурой плавления: они имеют низкую температуру плавления, что обусловлено слабыми межатомными связями в кристаллической решетке. Это позволяет им быть жидкими при комнатной температуре или очень низких температурах.
Атомная структура щелочных металлов
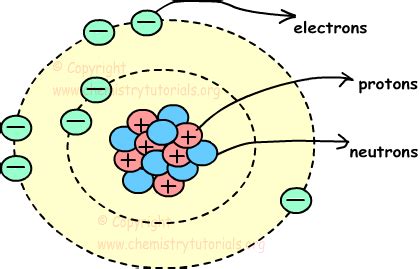
Щелочные металлы - это группа элементов периодической таблицы, включающая литий, натрий, калий, рубидий, цезий и франций. Атомы щелочных металлов имеют простую атомную структуру, которая определяет их особенности и свойства.
Каждый атом щелочного металла состоит из ядра и электронной оболочки. В ядре находятся протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны - не имеют заряда. Количество протонов определяет атомный номер элемента.
Вокруг ядра находится электронная оболочка, состоящая из электронов. Количество электронов равно количеству протонов и определяет электрическую нейтральность атома. Электроны располагаются на энергетических уровнях, называемых оболочками. Первая оболочка может вместить максимум 2 электрона, вторая - 8, третья - 18 и так далее.
У щелочных металлов на внешнем энергетическом уровне находится один электрон. Это делает их очень активными химическими элементами, так как они стремятся потерять это электрон и достичь стабильной конфигурации, в которой внешняя оболочка будет полностью заполнена. Щелочные металлы способны образовывать положительные ионы, которые обычно обозначаются знаком "+".
Атомная структура щелочных металлов является одной из причин их высокой реактивности. Они легко реагируют с водой, кислородом и другими веществами, образуя соединения. Эта реактивность делает щелочные металлы полезными в различных областях, включая производство батареек, стекла, мыла и других химических соединений.
Свойства кристаллической решетки щелочных металлов

Кристаллическая решетка щелочных металлов имеет своеобразные свойства, которые определяют их уникальные химические и физические характеристики.
Основным свойством кристаллической решетки щелочных металлов является ионная структура. Ионы металлов имеют положительный заряд, а электроны образуют облако, окружающее эти ионы. Такая структура обеспечивает высокую электропроводность и теплопроводность щелочных металлов.
Кристаллическая решетка щелочных металлов обладает также высокой плотностью упаковки и малым размером кристаллических частиц, что позволяет им образовывать твердые, пластичные и хрупкие материалы с низкой температурой плавления и высокой температурой кипения.
Щелочные металлы обладают высокой химической активностью, и их кристаллическая решетка обеспечивает хорошую растворимость в воде и широкий спектр реакций с другими веществами. Однако, в силу своей активности, они подвержены коррозии и реакции с кислородом и влагой воздуха.
Кристаллическая решетка щелочных металлов также обладает высокой механической прочностью, что делает их идеальными материалами для изготовления строительных и электронных компонентов.
Ионная радиус и электронная структура щелочных металлов
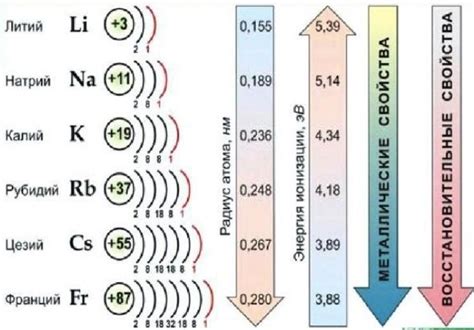
Ионная радиус – это расстояние от ядра до внешней оболочки атома, представляющей заряд вещества. В случае щелочных металлов ионный радиус обратно пропорционален заряду ионов. Щелочные металлы имеют заряд +1, поэтому их ионный радиус является наибольшим среди всех элементов. В основном состоянии ионный радиус щелочных металлов увеличивается внутри группы, а уменьшается вдоль периода.
Электронная структура щелочных металлов имеет особенности, связанные с положением этих элементов в периодической системе. Щелочные металлы находятся в первой колонке периодической системы, что означает, что у них во внешней электронной оболочке находится всего один электрон. Этот электрон легко отделяется от атома, поэтому щелочные металлы сильные восстановители и реагируют с водой, кислородом и многими другими веществами.
Электронная структура щелочных металлов обычно записывается в формате: K (2-номер энергетического уровня) 2, 8, 1 (количество электронов на каждом энергетическом уровне). У каждого щелочного металла внешний электрон находится на s-орбитали и имеет энергию, близкую к энергии внутренних s-орбиталей. Это делает электроны щелочных металлов доступными для участия в химических реакциях и обуславливает их химическую активность.
Взаимодействие щелочных металлов с другими веществами

Взаимодействие щелочных металлов с другими веществами проявляется во многих химических реакциях, которые сопровождаются образованием новых соединений. Один из таких видов реакций – реакция металла щелочноземельного металла с кислородом. При таком взаимодействии образуется оксид металла и алкалий, который проявляет живое вещество и легко вступает во все химические реакции.
Кроме того, щелочные металлы реагируют с поверхностно-активными веществами, такими как вода или органические растворители. В контакте с водой, щелочные металлы быстро растворяются, образуя щелочные растворы. При этом происходит выделение водорода. Реакция щелочных металлов с водой является достаточно интенсивной и может сопровождаться кипением или всплесками.
Взаимодействие щелочных металлов с кислотами также не остается без следа. При нагревании или даже при комнатной температуре происходит реакция, при которой щелочной металл вытесняет водород из кислородсодержащего соединения. В результате образуются соответствующие соли щелочных металлов.
Взаимодействие щелочных металлов с неталькими металлами также является важным аспектом химических реакций. При реакции с металлами щелочные металлы обычно вытесняют неблагоприятные металлы, превращая их в соли или осаждая их в виде нерастворимых соединений. Это позволяет использовать щелочные металлы в процессах очистки от примесей или получения чистых металлов.
Вопрос-ответ

Какие элементы входят в группу щелочных металлов?
В группу щелочных металлов входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Чем отличается строение атомов щелочных металлов от атомов других элементов?
Атомы щелочных металлов имеют одну внешнюю электронную оболочку с одним электроном, что делает их химически активными и склонными к образованию ионов.
Какие особенности связаны со строением молекул щелочных металлов?
Молекулы щелочных металлов обычно образуются из двух атомов, которые образуют ковалентную связь. В случае кислорода и серы, атомы щелочных металлов образуют молекулы с двойными и тройными связями.
Чем обусловлено низкое плавление и кипение щелочных металлов?
Низкое плавление и кипение щелочных металлов обусловлено слабой силой притяжения между ионами в их кристаллической решетке. У щелочных металлов также очень низкое значение температуры ионизации, что делает их очень реактивными.
