Металлы - это особый класс элементов, характеризующихся высокой электропроводностью, теплопроводностью и обладающих способностью приобретать блестящую поверхность. Они имеют специфическую структуру, которая объясняет их уникальные свойства. Строение простых веществ металлов основано на существовании металлической связи.
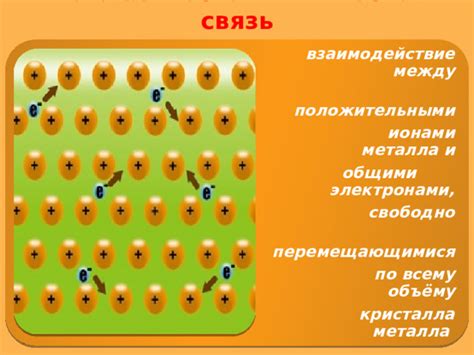
Металлическая связь является основой для формирования структуры металлов. Она представляет собой взаимодействие свободных электронов с ионными ядрами металла. Ионные ядра в металлах обладают положительным зарядом и располагаются в решетке, образуя кристаллическую структуру. Свободные электроны можно представить как облако, окружающее эти ионные ядра. Они не привязаны к определенным атомам и могут свободно двигаться в кристаллической решетке.
Строение металлической решетки обуславливает особые свойства металлов. Свободные электроны, находясь в постоянном движении, создают электронное облако. Именно поэтому металлы обладают высокой электропроводностью. Кроме того, подобная структура способствует их высокой теплопроводности, так как электроны эффективно передают тепловую энергию.
Металлическая связь ведет к образованию металлической решетки, которая характеризуется высокой степенью упорядоченности и взаимодействия между атомами. Такая структура придает металлам их механическую прочность и способность образовывать сплавы с другими металлами.
Изучение строения простых веществ металлов и металлической связи имеет большое практическое значение. Оно позволяет лучше понять их физические и химические свойства, а также использовать эту информацию при создании новых материалов с определенными свойствами. Важно отметить, что связь между свободными электронами и ионными ядрами может быть ослаблена или нарушена в реакциях с другими веществами, что делает металлы реактивными веществами.
Значение металлической связи в строении простых веществ
Металлическая связь является основным фактором, определяющим строение простых веществ металлов. Она влияет на физические и химические свойства металлов, а также на их способность проводить тепло и электричество.
Металлическая связь возникает благодаря особенностям строения атомов металла. Они имеют относительно малое количество валентных электронов, что позволяет им образовывать электронные облака, свободно передвигающиеся по кристаллической решетке. Эти электроны образуют своего рода "море", в котором атомы металла "плавают".
Структура металлической решетки обеспечивает высокую прочность металлов. Атомы металла упакованы плотно и регулярно, что позволяет им переносить большие нагрузки без легкого деформирования или разрушения.
Металлическая связь также обуславливает высокую теплопроводность и электропроводность металлов. Благодаря свободному движению электронов, тепловая энергия и электрический ток могут легко передаваться через металлическую решетку.
В целом, значимость металлической связи в строении простых веществ металлов выражается во множестве их уникальных свойств, таких как высокая прочность, теплопроводность и электропроводность.
Описание строения атомов металлов

Атомы металлов имеют особенное строение, которое обусловлено наличием свободных электронов в их внешних энергетических оболочках. Основу атома металла составляет ядро, которое содержит протоны (положительно заряженные частицы) и нейтроны (частицы без заряда). Эти частицы находятся в центре атома и образуют его массу.
Вокруг ядра находятся электроны, которые движутся по определенным орбитам, называемым энергетическими уровнями или оболочками. Каждая оболочка может вмещать определенное количество электронов. Первая оболочка может содержать не более 2 электронов, вторая оболочка - не более 8 электронов, третья оболочка - не более 18 электронов, и так далее.
Особенностью атомов металлов является то, что их внешняя оболочка не заполнена полностью. К примеру, оболочка может вмещать 8 электронов, но содержать только 2. Это означает, что внешняя оболочка атома металла содержит свободные, не связанные с ядром электроны.
Именно наличие свободных электронов во внешней оболочке атома металла обуславливает его металлические свойства, такие как теплопроводность, электропроводность и пластичность. Свободные электроны могут свободно двигаться по веществу, образуя так называемое "море электронов". Это море электронов обеспечивает соединение атомов металлов между собой, создавая металлическую связь и делая металлы проводниками электричества и тепла.
Расположение электронов в энергетических уровнях

Электроны - негативно заряженные элементарные частицы, находящиеся вокруг ядра атома. Они расположены на энергетических уровнях, которые представляют собой дискретные значения энергии, на которых электроны могут находиться.
Наиболее близкие к ядру уровни имеют меньшую энергию и называются внутренними или нижними энергетическими уровнями. Дальние от ядра уровни имеют более высокую энергию и называются внешними или высшими энергетическими уровнями.
Правило Ауфбау, или "строительства", указывает на то, каким образом электроны заполняют энергетические уровни в атоме. Согласно этому правилу, электроны будут заполнять энергетические уровни по порядку возрастания их энергии. То есть, на первом уровне будет находиться 2 электрона, на втором - 8 электронов, на третьем - 18 электронов и так далее.
Одна из основных характеристик электронного строения атома - его электронная конфигурация. Электронная конфигурация описывает расположение всех электронов в атоме по энергетическим уровням и подуровням. Например, электронная конфигурация атома кислорода: 1s2 2s2 2p4.
Кристаллическая структура металлов

Металлы обладают особым типом кристаллической структуры, называемой металлической решеткой. Она отличается от кристаллических структур других веществ, таких как ионные или ковалентные решетки.
В металлической решетке атомы металла занимают определенные позиции, образуя регулярное трехмерное упорядочение. Главной особенностью металлической решетки является наличие свободно движущихся электронов, которые являются ответственными за характерные свойства металлов, такие как теплопроводность и электропроводность.
Атомы в металлической решетке располагаются в точках решетки, называемых узлами. Узлы соединяются между собой стержнями, которые образуют ребра решетки. Эти ребра представляют собой связи между атомами и обладают их основными химическими свойствами, такими как металлическая связь и деформация.
Металлическая структура металлов может быть разной в зависимости от вида и состава металла. Для описания металлической структуры применяют специальные обозначения и термины, такие как кубическая гранецентрированная решетка (КГЦР), кубическая гранецентрированная решетка (КЦР), гексагональная решетка и другие.
Особенности связи между атомами в кристаллической решетке
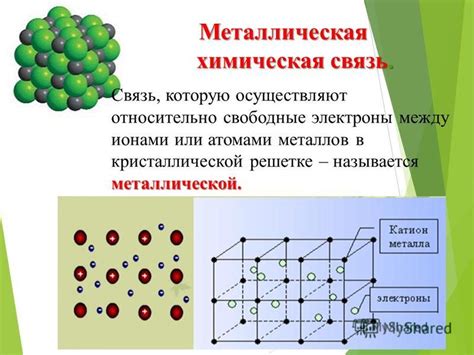
Кристаллическая решетка - это трехмерная структура, в которой атомы металла упорядочены в определенном порядке и расположены на определенном расстоянии друг от друга. Связь между атомами в кристаллической решетке имеет свои особенности.
В металлической связи свободные электроны образуют общую электронную оболочку для всех атомов в решетке. Это позволяет атомам перемещаться внутри решетки, создавая эффект подвижности металлической среды.
Кристаллическая решетка металла обычно имеет определенную симметрию, что обуславливает свойства и структуру металлов. Также в решетке могут присутствовать дефекты, такие как вакансии (отсутствие атома) или междоатомные дефекты, которые могут влиять на механические и электрические свойства материала.
Кроме того, межатомные расстояния в решетке металлов обычно малы, что обусловлено тесной упаковкой атомов. Это позволяет металлам обладать высокой плотностью и хорошей проводимостью электричества и тепла.
Таким образом, связь между атомами в кристаллической решетке металлов обусловлена общей электронной оболочкой, симметрией решетки и тесной упаковкой атомов. Это обеспечивает металлам уникальные свойства и важность в различных областях нашей жизни.
Эффекты и свойства металлической связи

Металлическая связь является одной из основных форм химической связи в металлах. Она обусловлена наличием свободных электронов в кристаллической решетке, которые образуют так называемое "электронное облако". Эта связь имеет ряд особых свойств и эффектов, которые делают металлы уникальными и полезными в различных областях промышленности и науки.
- Проводимость тока: Свободные электроны в металлической связи способны свободно перемещаться по кристаллической решетке металла. Именно благодаря этому металлы обладают хорошей электропроводностью, что делает их необходимыми материалами для создания проводников и электронных устройств.
- Теплопроводность: Кроме того, свободные электроны в металлической связи эффективно переносят тепло. Поэтому металлы обладают высокой теплопроводностью, что позволяет использовать их в конструкциях, требующих эффективного отвода тепла, например, в системах охлаждения.
- Пластичность: В металлической связи свободные электроны слабо связаны с положительно заряженными ионами металла. Это приводит к возможности смещения атомов в кристаллической решетке, что основой для пластичности металлов. Они легко поддаются обработке, удару и деформации, что делает их идеальными материалами для создания различных изделий.
Другими эффектами металлической связи являются:
- Электронная оптическая прозрачность, которая позволяет некоторым металлам быть прозрачными для определенных видов электромагнитного излучения;
- Ферромагнетизм, проявляющийся в возможности металлов образовывать постоянные магнитные поля;
- Каталитическая активность, благодаря которой металлы могут ускорять химические реакции, участвуя в процессах окисления и восстановления;
- Высокая плавкость и кипение, позволяющие использовать металлы для получения слитков, проволоки и других изделий методом плавления.
Роль металлической связи в свойствах и применении металлов

Металлическая связь играет важную роль в формировании свойств и применении металлов. Эта особая связь между атомами металла обеспечивает его устойчивую структуру и способность проводить электрический ток.
В металлической связи электроны внешних оболочек атомов металла образуют общий электронный газ, который свободно движется внутри кристаллической решетки металла. Это делает металлы отличными проводниками тепла и электричества.
Металлическая связь также обеспечивает металлам их высокие пластичность и прочность. В кристаллической решетке атомы металла образуют регулярные структуры, но благодаря подвижности электронов, металлы могут легко подвергаться деформациям без разрушения. Это позволяет использовать металлы для создания различных изделий, от автомобилей и самолетов до домашних принадлежностей и электронных устройств.
Применение металлов в различных отраслях промышленности также обусловлено их способностью образовывать металлическую связь. Например, металлы широко используются в строительстве благодаря своей прочности и долговечности. Они также используются в производстве электрических проводов, скрепляющих металлических деталей, создании машиностроительных конструкций и многое другое.
Таким образом, металлическая связь играет существенную роль в свойствах и применении металлов, обеспечивая им устойчивую структуру, способность проводить электричество, высокую пластичность и прочность. Благодаря этой особенности металлы остаются одним из самых важных и широко используемых материалов в различных отраслях промышленности и повседневной жизни.
Вопрос-ответ

Каково строение простых веществ металлов?
Строение простых веществ металлов характеризуется решеткой, состоящей из положительно заряженных ионов металла и свободно движущихся электронов. Ионы металла занимают определенные места в решетке, они образуют кристаллическую структуру.
Что такое металлическая связь?
Металлическая связь – это связь между положительно заряженными ионами металла и свободно движущимися электронами. В металлической связи электроны не принадлежат ни к одному конкретному атому, они свободно перемещаются по всей металлической решетке, что делает металлы отличными проводниками электричества и тепла.
Какова роль свободных электронов в металлической связи?
Свободные электроны играют ключевую роль в металлической связи. Они не привязаны к конкретным атомам, а свободно перемещаются по металлической решетке. Это обеспечивает металлам их уникальные свойства, такие как отличная проводимость электричества и тепла, способность к пластичности и проволочности.
