Щелочные металлы - это группа элементов, которая включает в себя литий, натрий, калий, рубидий, цезий и франций. Они относятся к первой группе периодической системы элементов и имеют один валентный электрон в своей внешней оболочке. Строение атомов этих металлов определяет их химические свойства и способность образовывать гидриды.
Атомы щелочных металлов имеют простую структуру - они состоят из ядра, в котором находятся протоны и нейтроны, и электронной оболочки. Внешняя оболочка, или валентная оболочка, содержит один электрон. Именно этот электрон отвечает за химические свойства щелочных металлов и позволяет им образовывать стабильные соединения с другими элементами.
Гидриды щелочных металлов являются соединениями, в которых атомы металла образуют связь с атомами водорода. Гидриды обладают рядом химических свойств, которые объясняются структурой атомов металлов и образующимися связями. Атомы металла в гидридах имеют положительный заряд, а атомы водорода - отрицательный заряд. Это объясняет их сильное химическое взаимодействие и способность гидридов быть сильно реактивными веществами.
Строение атомов щелочных металлов
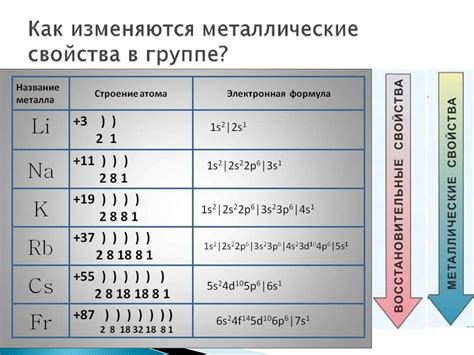
Атомы щелочных металлов, таких как литий (Li), натрий (Na), калий (K) и другие, имеют уникальную структуру. Щелочные металлы находятся в первой группе периодической системы и имеют одну электронную оболочку, заполненную отдельным электроном.
Строение атома щелочного металла можно представить следующим образом: в центре находится ядро, состоящее из протонов и нейтронов. Вокруг ядра движется электронная оболочка, где находится один электрон, обладающий отрицательным зарядом.
Одноэлектронное строение атомов щелочных металлов делает их очень реактивными. Это связано с тем, что эти металлы стремятся избавиться от этого одного электрона, чтобы достичь более стабильного состояния с полностью заполненной внешней оболочкой. В результате щелочные металлы легко образуют ионы с положительным зарядом, например, ион лития (Li+) или ион натрия (Na+).
Химические свойства щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., обладают рядом уникальных химических свойств, которые определяют их поведение в химических реакциях.
Первое химическое свойство щелочных металлов - способность образовывать ионы с положительным зарядом. Ионы щелочных металлов имеют заряд +1 и являются основными катионами в реакциях.
Второе химическое свойство - реакция с водой. Щелочные металлы быстро и энергично реагируют с водой, образуя гидроксиды и выделяя водород. Например, натрий при контакте с водой образует гидроксид натрия и водород:
- 2Na + 2H₂O → 2NaOH + H₂
Третье химическое свойство - реакция с кислородом. Щелочные металлы воспламеняются на воздухе и горят с фиолетовым пламенем, образуя оксиды. Например, литий горит в воздухе, образуя оксид лития:
- 4Li + O₂ → 2Li₂O
Четвертое химическое свойство - образование гидридов. Щелочные металлы могут реагировать с водородом, образуя гидриды. Гидриды щелочных металлов являются сильными восстановителями и могут использоваться в различных химических процессах.
В заключение, химические свойства щелочных металлов определяют их широкое применение в различных областях, включая промышленность, электроэнергетику и научные исследования.
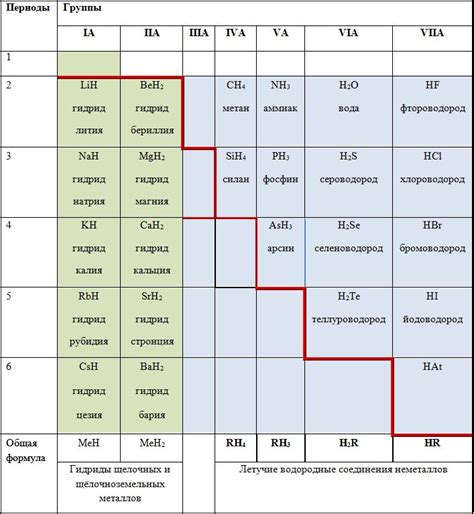
Образование гидридов щелочных металлов

Гидриды щелочных металлов представляют собой соединения, в которых атомы щелочных металлов образуют ионы, связанные с атомами водорода. Образование гидридов щелочных металлов является важным процессом в химии этих элементов.
Гидриды щелочных металлов имеют сильно выраженные щелочные свойства и готовность отдать ион водорода. Это связано с тем, что атомы щелочных металлов обладают низкой электроотрицательностью, что позволяет им легко принимать электроны от водородных атомов.
Гидриды щелочных металлов обычно образуются путем взаимодействия щелочных металлов со взятим атомом водорода. Это может происходить в результате химической реакции или поглощения водорода из окружающей среды.
Важно отметить, что гидриды щелочных металлов обладают большой химической активностью и реагируют с водой, кислородом, аммиаком и многими другими веществами. Это делает их полезными для различных промышленных процессов и технологий, таких как производство водорода, катализаторы и электронные компоненты.
Химические свойства гидридов щелочных металлов

Гидриды щелочных металлов - это химические соединения, образованные в результате реакции металлов с водородом. Они обладают рядом уникальных химических свойств, которые определяют их применение в различных областях.
Одной из важных характеристик гидридов щелочных металлов является их способность к реакции с водой. При контакте с водой они могут выделять водородный газ, что делает их полезными в промышленности и энергетике. Некоторые гидриды щелочных металлов могут образовывать еще более сильные кислоты, чем вода, что делает их потенциальными кандидатами для использования в батареях и аккумуляторах.
Гидриды щелочных металлов также обладают высокой термической и электрической проводимостью. Это позволяет им использоваться в процессе производства легированных сплавов, а также в изготовлении различных электронных компонентов, таких как транзисторы и диоды.
Кроме того, гидриды щелочных металлов обладают способностью к реакции с различными органическими соединениями, что делает их полезными в органическом синтезе. Они могут служить катализаторами в химических реакциях, ускоряя их протекание и обеспечивая высокую степень конверсии.
В целом, химические свойства гидридов щелочных металлов предоставляют широкие возможности для их использования в различных областях, от промышленности до науки. Изучение их химических свойств позволяет разрабатывать новые материалы и применения для этих соединений, что способствует развитию современных технологий и научных исследований.
Взаимодействие щелочных металлов и гидридов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, проявляют высокую активность во взаимодействии с гидридами. Гидриды представляют собой химические соединения, содержащие водород в отрицательной степени окисления.
Взаимодействие щелочных металлов с гидридами приводит к образованию гидридов щелочных металлов. Эти соединения обладают высокой реактивностью и широким спектром применений.
Физические свойства гидридов щелочных металлов могут значительно отличаться в зависимости от состава и структуры. Некоторые гидриды щелочных металлов являются непроводниками, а другие - проводниками электричества.
В химическом отношении гидриды щелочных металлов могут взаимодействовать с различными веществами, такими как вода, кислород, хлор и другие химически активные соединения.
- Взаимодействие с водой: При контакте с водой гидриды щелочных металлов образуют гидроксиды и выделяются водородный газ.
- Взаимодействие с кислородом: Гидриды щелочных металлов могут гореть на воздухе при взаимодействии с кислородом, что сопровождается выделением большого количества тепла и света.
- Взаимодействие с хлором: При контакте с хлором гидриды щелочных металлов образуют соль и выделяются газы, такие как хлористоводород.
Взаимодействие щелочных металлов и гидридов является важным направлением в современной химии. Оно позволяет не только изучить свойства этих соединений, но и применить их в различных технологических процессах, таких как производство водорода и применение гидридов щелочных металлов в качестве катализаторов.
Вопрос-ответ

Каково строение атомов щелочных металлов?
Строение атомов щелочных металлов определяется их электронной конфигурацией. Они имеют один электрон во внешней оболочке, что делает их очень реакционноспособными и химически активными.
Как образуются гидриды щелочных металлов?
Гидриды щелочных металлов образуются путем реакции металла с водородом. Водаородное соединение металла называют его гидридом. При этой реакции металл отдает свой электрон водороду, образуя положительный ион металла, а водород вступает в реакцию с этим ионом, образуя отрицательный ион гидрида.
Какие химические свойства имеют гидриды щелочных металлов?
Гидриды щелочных металлов обладают рядом уникальных химических свойств. Они обычно являются сильными основаниями и могут реагировать с кислотами. Гидриды также обладают высокой теплопроводностью и хорошей электропроводностью. Они образуют металлические связи между атомами металла и водорода.
