Металлы побочных подгрупп являются основными материалами во многих отраслях промышленности. Они обладают уникальными свойствами, такими как высокая прочность, хорошая проводимость тепла и электричества, а также способность быть легко подвергнутыми формованию. Отличительной особенностью металлов побочных подгрупп является их строение, которое состоит из кристаллической решетки и границ зерен.
Кристаллическая решетка металлов побочных подгрупп представляет собой упорядоченную структуру, состоящую из множества атомов, расположенных в определенном порядке. Этот порядок обеспечивает прочность материала и его способность к деформации без разрушения. Кристаллическая решетка металлов побочных подгрупп обладает высокой плотностью и взаимной проницаемостью атомов, что обуславливает их механические и физические свойства.
Границы зерен отделяют отдельные кристаллы в металлах побочных подгрупп. Они являются областями с повышенной дефектностью, где атомы имеют другое упорядочение, чем внутри кристаллов. Границы зерен влияют на общую прочность и устойчивость материала к различным внешним факторам. Отличительной особенностью границ зерен является их местоположение и форма, которые могут быть различными в разных металлах побочных подгрупп, что влияет на их свойства и особенности.
Строение металлов побочных подгрупп

Строение металлов побочных подгрупп представляет собой упорядоченную кристаллическую решетку, состоящую из атомов металла. Эта решетка обладает высокой степенью симметрии и регулярностью, что является основной причиной таких свойств металлов, как прочность и пластичность.
Атомы металла в кристаллической решетке соединены между собой металлическими связями, которые обеспечивают хорошую проводимость электричества и тепла. Металлические связи характеризуются свободной подвижностью электронов, что делает металлы отличными проводниками электрического тока.
Строение металлов побочных подгрупп также можно описать с точки зрения их атомного или ионного строения. Кристаллическая решетка состоит из однородных элементарных ячеек, которые содержат один или несколько атомов металла. Атомы в ячейке могут располагаться в углах и на гранях ячейки, что определяет ее форму и размеры.
В зависимости от типа металла и его побочной подгруппы, строение может быть различным. Например, металлы побочных подгрупп I и II (щелочные и щелочноземельные металлы) образуют кубическую решетку, а металлы побочных подгрупп III и IV (легкие и тяжелые металлы) образуют гексагональную или ромбическую решетку.
Организация элементов в металлах
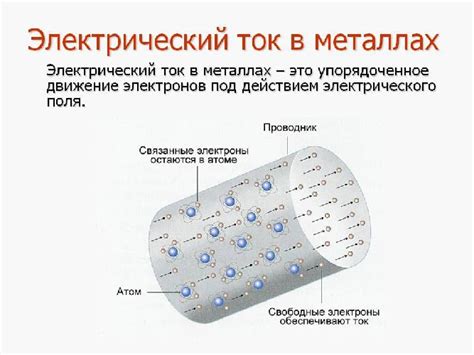
Металлы представляют собой материалы, состоящие из атомов, которые упорядочены в определенной решетке. Такая организация элементов в металлах обусловлена их внутренней структурой.
Атомы металлов образуют кристаллическую решетку, которая имеет регулярную, периодическую структуру. В этой решетке атомы располагаются в узлах и занимают определенные места с определенными координатами. Организация элементов в металлах в кристаллической решетке обеспечивает прочность и устойчивость материала.
Основной тип решеток, в которых организованы элементы в металлах, - это кубические. В кубических решетках атомы располагаются на узлах кубиков и имеют одинаковые расстояния между соседними атомами. В зависимости от размеров решетки и взаимного расположения атомов в ней, можно выделить несколько разновидностей кубических решеток, таких как гранецентрированная, простая гранецентрированная и гексагонально-гранецентрированная решетки.
Интересной особенностью организации элементов в металлах является их способность образовывать сплавы - материалы, состоящие из двух или более металлов. В сплавах атомы металлов могут располагаться в различных композиционных структурах, что делает их особенно востребованными в промышленности.
Таким образом, организация элементов в металлах играет важную роль в их свойствах и характеристиках. Знание структурных особенностей металлов позволяет более глубоко понять их поведение при воздействии внешних факторов и использовать их в различных областях нашей жизни.
Кристаллическая структура металлов

Металлы отличаются своей специфической кристаллической структурой, которая обусловлена особым расположением атомов в них. Общая кристаллическая структура металлов представляет собой трехмерную сетку, в которой атомы металла занимают определенные позиции.
Одной из самых распространенных кристаллических структур металлов является плотная упаковка атомов. В этой структуре атомы размещаются как можно ближе друг к другу, образуя компактные кристаллы. Такая структура обеспечивает металлам высокую прочность и устойчивость.
Еще одной распространенной кристаллической структурой металлов является кубическая гранецентрированная решетка. В этой структуре атомы металла располагаются на вершинах и в центрах граней куба. Эта структура обладает высокой плотностью упаковки атомов и также обеспечивает металлам прочность и устойчивость.
Некоторые металлы имеют специальную кристаллическую структуру, например, железо и сталь имеют структуру, называемую ферритной. В этой структуре атомы железа образуют кубическую решетку, в которой одна из диагоналей протягивается через центр куба. Это придает металлу дополнительную прочность и особые свойства.
Межатомное взаимодействие
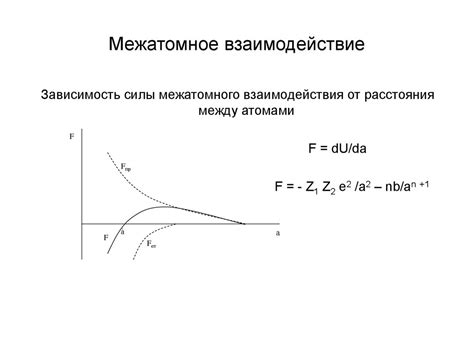
Межатомное взаимодействие - это основной фактор, определяющий строение и свойства металлов. Оно обусловлено электростатическими силами притяжения и отталкивания между атомами. Металлическая решетка состоит из положительно заряженных ионов металла, расположенных в упорядоченном и регулярном порядке.
Взаимодействие между атомами металла характеризуется высокой прочностью и гибкостью решетки. Это обусловлено тем, что положительные ионы металла не имеют фиксированного положения, а свободно перемещаются в решетке. Благодаря этому металлы обладают высокой пластичностью и могут быть легко исковерканы без разрушения структуры вещества.
Основными видами межатомного взаимодействия в металлах являются ионно-электронное взаимодействие и постоянное взаимодействие. Ионно-электронное взаимодействие основано на притяжении между положительно заряженными ионами металла и отрицательно заряженными электронами. Постоянное взаимодействие обусловлено наличием электростатических сил притяжения и отталкивания между атомами, которые поддерживают их упорядоченное расположение в решетке.
Межатомное взаимодействие также определяет такие свойства металлов, как электропроводность, теплопроводность и металлический блеск. Благодаря высокой подвижности электронов в металлической решетке, металлы обладают хорошей электропроводностью. Теплопроводность металлов обусловлена высокой подвижностью ионов, которая позволяет эффективно передавать тепло через решетку. Металлический блеск проявляется благодаря способности электронов поглощать и испускать видимый свет.
Дефекты в кристаллической решетке

Кристаллическая решетка металла может содержать различные дефекты, которые влияют на его свойства и структуру. Дефекты могут возникать как в результате процессов формирования кристаллической решетки, так и вследствие внешних воздействий.
Одним из основных типов дефектов являются точечные дефекты, представленные вакансиями в кристаллической решетке – отсутствием атомов на определенном месте. Эти дефекты могут быть созданы при охлаждении материала или в результате динамических процессов в кристаллической решетке.
Еще одним типом дефектов являются линейные дефекты, их представляют собой одномерные дефекты, которые складываются из проскальзывания атомов друг относительно друга. Линейные дефекты могут быть созданы в результате механического нагружения материала.
Объемные дефекты являются наиболее серьезными, так как они затрагивают большое количество атомов в кристаллической решетке. Такие дефекты могут возникать при длительных периодах теплового воздействия или в результате воздействия различных физических и химических факторов.
Все эти дефекты существенно влияют на свойства металла, такие как прочность, твердость, пластичность и электропроводность. Изучение дефектов в кристаллической решетке помогает понять их влияние на механическое и электрическое поведение материала и разработать способы его улучшения.
Фазовые превращения в металлах
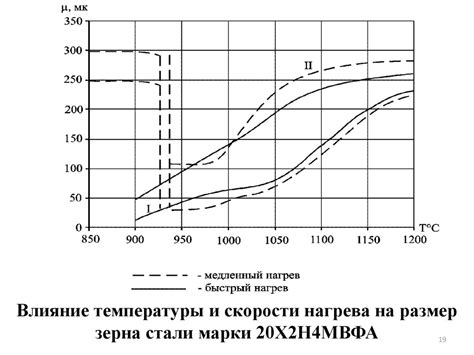
Фазовые превращения в металлах являются важным аспектом их свойств и поведения. Металлы способны испытывать различные фазовые превращения в ответ на изменение условий окружающей среды, таких как температура и давление.
Наиболее известными фазовыми превращениями в металлах являются плавление и кристаллизация. При повышении температуры металлы могут переходить из твердого состояния в жидкое (плавление), а при охлаждении - из жидкого состояния в твердое (кристаллизация).
Кроме того, металлы могут подвергаться и другим фазовым превращениям, таким как мартенситное превращение, рекристаллизация и осаждение. Мартенситное превращение происходит при быстром охлаждении металла и приводит к изменению его структуры и свойств. Рекристаллизация и осаждение, напротив, являются процессами восстановления и определения новых структур частиц металла после обработки или нагрева.
Фазовые превращения в металлах имеют существенное влияние на их механические, электрические и тепловые свойства. Знание и управление фазовыми превращениями в металлах является ключевым аспектом их применения в различных отраслях промышленности, включая машиностроение, электронику и строительство.
Механические свойства металлов побочных подгрупп
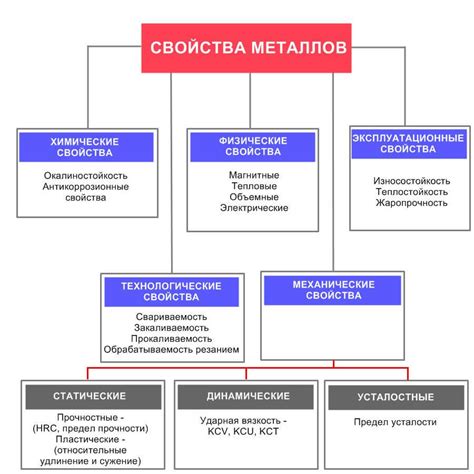
Металлы побочных подгрупп обладают высокими механическими свойствами, что делает их популярным материалом в машиностроении и других отраслях промышленности. Одной из ключевых характеристик является прочность. Металлы побочных подгрупп обладают большой прочностью на разрыв, что позволяет использовать их в конструкциях, подвергающихся большим нагрузкам.
Помимо прочности, металлы побочных подгрупп обладают высокой устойчивостью к деформации. Они обладают способностью возвращаться к своей исходной форме после снятия нагрузки. Это свойство называется упругостью и является одним из ключевых механических параметров металлов побочных подгрупп.
Металлы побочных подгрупп также характеризуются высокой пластичностью. Они способны легко поддаваться пластической деформации без разрушения. Это свойство позволяет металлам побочных подгрупп легко принимать нужную форму при обработке и изготовлении изделий.
Кроме того, металлы побочных подгрупп обладают высокой твердостью. Это свойство определяет их способность сопротивляться различным внешним воздействиям, в том числе и истиранию. Благодаря высокой твердости, металлы побочных подгрупп могут использоваться в условиях повышенного трения без значительного износа.
Вопрос-ответ

Каково строение металлов побочных подгрупп?
Строение металлов побочных подгрупп обычно кристаллическое, где атомы металла размещены в регулярной решетке.
Какие свойства характерны для металлов побочных подгрупп?
Металлы побочных подгрупп обладают высокой электропроводностью, теплопроводностью и пластичностью. Они также имеют хорошую механическую прочность и способность образовывать сплавы с другими металлами.
Что делает металлы побочных подгрупп такими прочными?
Металлы побочных подгрупп обладают прочностью благодаря своему кристаллическому строению и наличию межатомных связей, которые позволяют им выдерживать большие нагрузки без разрушения.
Какие химические свойства металлов побочных подгрупп?
Металлы побочных подгрупп обычно обладают активным химическим поведением. Они способны взаимодействовать с различными веществами, образуя соединения и реагируя с кислотами и щелочами.
В чем особенности металлов побочных подгрупп по сравнению с основными металлами?
Металлы побочных подгрупп обычно имеют более сложное строение и разнообразные свойства по сравнению с основными металлами. Они также могут быть менее распространенными и более дорогими в производстве.
