Щелочноземельные металлы — это группа химических элементов, расположенных во второй группе периодической таблицы. В данную группу входят металлы, следующие за щелочными металлами: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Эти элементы обладают рядом сходных химических свойств, включая низкую электроотрицательность и активность.
Строение щелочноземельных металлов в значительной степени определяется их электронной конфигурацией. Бериллий, магний, кальций, стронций и барий имеют семь электронов на внешней энергетической оболочке, что делает их очень реактивными. Радий, находящийся в самом низу группы, имеет девять электронов на внешней оболочке и является радиоактивным элементом.
Любой элемент этой группы обладает общей химической формулой ns², где n обозначает энергетический уровень. Это означает, что внешняя оболочка каждого щелочноземельного металла содержит два электрона. Это делает их готовыми к потере этих электронов и образованию положительных ионов.
Кроме того, строение щелочноземельных металлов определяется их атомной структурой. Бериллий и магний имеют компактную атомную структуру с кристаллической решеткой гексагонального типа. Кальций, стронций и барий имеют ромбическую решетку, а радий имеет кубическую решетку.
Элементы группы щелочноземельных металлов также имеют характерные свойства, связанные со строением их атомов. Например, все они образуют сильные ионные связи с халкогенами, такими как кислород, сера и селен.
Элементы щелочноземельных металлов: строение и свойства

Щелочноземельные металлы представляют собой вторую группу периодической системы элементов. К ним относятся бериллий, магний, кальций, стронций, барий и радий. Все они имеют сходные характеристики, такие как низкую плотность, малую твердость и низкую точку плавления.
Строение щелочноземельных металлов основывается на их электронной конфигурации. Все они имеют общую электронную конфигурацию s^2, что делает их очень реактивными. Это связано с тем, что у них два электрона в валентной оболочке, что позволяет им участвовать во множестве химических реакций.
Свойства щелочноземельных металлов определяются их высокой реактивностью. Они легко реагируют с кислородом, образуя оксиды, а с водой - гидроксиды. При реакции металлы образуют одно- или двузарядные ионы, что делает их важными в процессах электролиза.
Щелочноземельные металлы также обладают хорошей термической и электрической проводимостью. Они имеют высокую способность образовывать сплавы с другими металлами, что делает их важными компонентами в производстве различных сплавов и сталей.
Основные характеристики щелочноземельных металлов

Щелочноземельные металлы - это группа химических элементов, которые находятся во второй группе периодической таблицы. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). У щелочноземельных металлов есть ряд общих характеристик, которые их отличают от других элементов.
1. Электроотрицательность: Щелочноземельные металлы имеют низкую электроотрицательность, что делает их хорошими металлами, способными образовывать ионные связи с другими элементами.
2. Атомный радиус: Атомы щелочноземельных металлов имеют больший радиус по сравнению с атомами других элементов в своем периоде. Это связано с увеличением числа электронных слоев.
3. Химическая активность: Щелочноземельные металлы являются активными химическими элементами. Они реагируют с водой, кислородом и другими веществами, образуя ионы положительной заряды.
4. Плавление и кипение: Щелочноземельные металлы имеют низкую температуру плавления и кипения. Например, кальций плавится при температуре всего лишь 842 градуса Цельсия.
5. Электропроводность: Щелочноземельные металлы хорошие проводники электричества. Это связано с наличием свободных электронов в их валентной оболочке.
6. Способность образовывать соединения: Щелочноземельные металлы образуют разнообразные соединения с другими элементами. Например, глинозем (алюминиевый оксид) совместно с бериллием используется для создания стекла.
- Широко используются в промышленности и в научных исследованиях.
- Участвуют в процессах жизнедеятельности живых организмов.
- Способствуют регулированию нервной и мышечной активности.
- Бериллий обладает высокой прочностью и используется в производстве аэрокосмической и нуклеарной техники.
- Магний применяется в легкой промышленности, в производстве сплавов и при конструкции летательных аппаратов.
- Кальций играет важную роль в формировании сильных костей и зубов, а также участвует в нормализации работы сердца и мышц.
- Стронций используется в производстве пиротехники, цветных стекол и в ядерной энергетике.
- Барий используется в рентгенологии для проведения медицинских исследований и диагностики.
- Радий является радиоактивным элементом и широко применяется в медицинской диагностике и лечении рака.
Таким образом, щелочноземельные металлы обладают рядом характеристик, которые определяют их свойства и применение в различных областях науки и промышленности.
Атомное строение щелочноземельных металлов

Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают особым атомным строением, которое определяет их химические и физические свойства.
Атомы щелочноземельных металлов имеют следующую электронную конфигурацию: ns2, где n обозначает энергетический уровень, а s обозначает подуровень s. Здесь ns2 указывает на то, что на последнем энергетическом уровне находится 2 электрона в подуровне s.
Такая электронная конфигурация влияет на свойства щелочноземельных металлов. Наличие двух электронов на последнем энергетическом уровне делает эти металлы химически активными. Они стремятся отдать эти электроны, чтобы достигнуть стабильной электронной конфигурации, а именно ns0.
Электроны щелочноземельных металлов могут образовывать ионы с положительным зарядом, например, ионы Mg2+, Ca2+ и другие. Эти ионы имеют стабильную электронную конфигурацию ns0, что делает их химически активными и способными формировать множество соединений.
Щелочноземельные металлы также характеризуются малым радиусом атома и высокой электроотрицательностью. Их атомы имеют малый радиус из-за сжатия электронных облаков, вызванного большим притяжением ядра к электронам. Благодаря высокой электроотрицательности, щелочноземельные металлы обладают высокой химической активностью и образуют разнообразные химические соединения.
Электронная конфигурация щелочноземельных металлов

Электронная конфигурация щелочноземельных металлов определяет распределение электронов в их атомах. Щелочноземельные металлы - это элементы второй группы периодической системы, которые включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Каждый атом щелочноземельных металлов имеет два электрона в своей внешней энергетической оболочке. Это делает их электронную конфигурацию стабильной и сходной между этими элементами.
Бериллий имеет электронную конфигурацию 1s^2 2s^2, что означает, что у него есть два электрона в s-подуровне своей внешней энергетической оболочки.
Магний имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^2, а кальций - 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2.
У стронция электронная конфигурация - 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2.
Барий имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2 4d^10 5p^6 6s^2.
У радия электронная конфигурация - 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^10 4p^6 5s^2 4d^10 5p^6 6s^2 4f^14 5d^10 6p^6 7s^2.
Электронная конфигурация щелочноземельных металлов позволяет им быть очень реактивными и легко образовывать ионы с положительным зарядом. Эти элементы имеют склонность отдавать два электрона, чтобы достичь стабильной октетной конфигурации.
В целом, электронная конфигурация щелочноземельных металлов демонстрирует распределение электронов в их атомах, что определяет их химические свойства и реактивность.
Строение кристаллической решетки щелочноземельных металлов
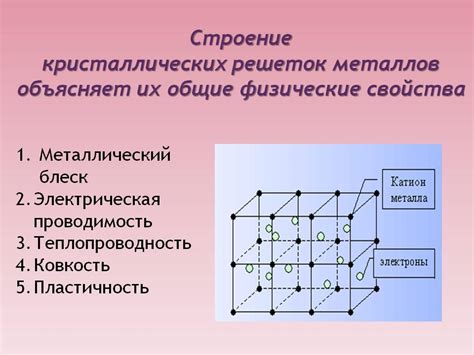
Строение кристаллической решетки щелочноземельных металлов имеет особенности, которые обусловлены их химическими свойствами и электронной структурой. Щелочноземельные металлы, такие как магний, кальций и стронций, обладают простой кубической решеткой, в которой каждый металл располагается в центре кубической ячейки и окружен шестью атомами металла.
Отличительной особенностью щелочноземельных металлов является наличие высокой плотности упаковки в их кристаллической решетке. Как результат, кристаллические решетки щелочноземельных металлов имеют высокую прочность и тугоплавкость. Также, благодаря компактному строению решетки, щелочноземельные металлы обладают низкой теплопроводностью и высокой пластичностью.
Кристаллическая решетка щелочноземельных металлов может быть представлена в виде трехмерной таблицы, где каждый атом металла занимает узел решетки. Эта структура позволяет щелочноземельным металлам образовывать кристаллы различных форм и размеров, включая мелкодисперсные порошки и большие кристаллы, используемые в электронике и металлургии.
В целом, строение кристаллической решетки щелочноземельных металлов играет ключевую роль в их химических и физических свойствах, влияя на проводимость электричества, магнитные свойства, плотность и др. Понимание данного строения позволяет разрабатывать новые материалы и улучшать существующие, что находит применение в различных отраслях науки и техники.
Физические свойства щелочноземельных металлов

Щелочноземельные металлы - это группа химических элементов, которые являются благородными металлами и находятся во второй группе периодической системы. Они включают в себя бериллий, магний, кальций, стронций, барий и радий. Физические свойства щелочноземельных металлов обусловлены их атомными и электронными структурами.
Первое физическое свойство щелочноземельных металлов - это их низкая плотность. Например, плотность бериллия составляет всего 1,85 г/см³, тогда как плотность бария достигает 3,61 г/см³. Это делает их легкими и удобными для использования в различных промышленных и технических приложениях.
Второе важное физическое свойство щелочноземельных металлов - это их низкая температура плавления. Например, магний плавится при температуре всего 650 градусов Цельсия, тогда как барий - при 727 градусах Цельсия. Это делает их легкообрабатываемыми и подходящими для использования в различных процессах и технологиях.
Еще одно физическое свойство щелочноземельных металлов - их способность проводить тепло и электричество. Благодаря наличию свободных электронов в их электронных оболочках, щелочноземельные металлы обладают хорошей электропроводностью и отличными теплоотдачей. Именно поэтому они широко применяются в производстве проводов, кабелей, теплопереносных систем и других устройств, требующих электрической и тепловой проводимости.
Кроме того, щелочноземельные металлы обладают высокой реактивностью и легкостью взаимодействия с другими элементами. Они способны образовывать стабильные соединения с кислородом, хлором, серой и другими элементами. Именно поэтому щелочноземельные металлы широко используются в различных химических процессах, фармацевтической и пищевой промышленности, а также в производстве стекла и керамики.
Вопрос-ответ

Каково строение атомов щелочноземельных металлов?
Атомы щелочноземельных металлов имеют сферическую форму, состоящую из ядра и электронной оболочки.
Чем отличается ядро атома щелочноземельного металла от электронной оболочки?
Ядро атома щелочноземельного металла содержит протоны и нейтроны, в то время как электронная оболочка состоит из электронов.
Какие элементы относятся к группе щелочноземельных металлов?
К группе щелочноземельных металлов относятся элементы бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радиоактивный радий (Ra).
Какие особенности имеют атомы щелочноземельных металлов?
Атомы щелочноземельных металлов имеют две электронные оболочки и два электрона в внешней оболочке, что делает их достаточно реактивными.
