Металлы 1 группы периодической системы Менделеева представляют собой важную категорию химических элементов. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs). Эти элементы обладают характерными свойствами, включая низкую плотность, низкую плавкую и кипящую температуру, а также относительно небольшую жесткость.
Электронная оболочка металлов 1 группы играет важную роль в их химическом поведении. Она состоит из внутренней оболочки, называемой ядром, и внешней оболочки, состоящей из электронов. Особенностью оболочки металлов 1 группы является наличие одного электрона в внешней оболочке. Такой электрон называется валентным и обладает особым значением в химических реакциях.
Валентный электрон металлов 1 группы является ответственным за способность этих элементов образовывать ионные соединения. При вступлении в химические реакции, валентный электрон может передаваться другому атому, что приводит к образованию положительного или отрицательного иона.
Кроме того, строение электронной оболочки металлов 1 группы определяет их способность проводить электрический ток. Электроны в внешней оболочке металлов 1 группы свободно передвигаются между атомами, образуя так называемые электронные облака. Это обусловливает хорошую электропроводность этих элементов и их способность к формированию электролитических соединений.
Группа периодической системы
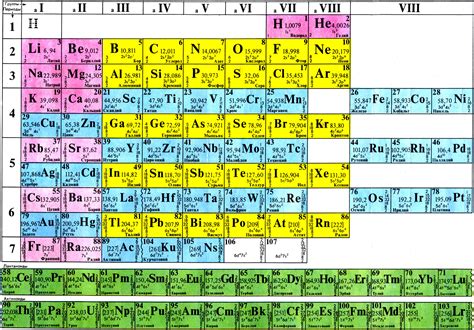
Группа периодической системы – это вертикальная колонка элементов, расположенных по возрастанию атомных номеров. Группа определяет количество электронов на внешней электронной оболочке атома. В периодической системе всего 18 групп.
Группа 1 периодической системы называется группой щелочных металлов. Она включает элементы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы имеют один электрон на внешней электронной оболочке и отдают его легко, образуя положительный ион. Из-за этой способности щелочные металлы реактивны и реагируют с водой и кислородом.
Литий является самым легким щелочным металлом и обладает наименьшей реактивностью в этой группе. Франций - самый тяжелый и нестабильный щелочный металл, поскольку его ядро содержит большое количество нейтронов. Щелочные металлы широко используются в различных областях, таких как производство щелочных батарей, жидкость для охлаждения реакторов и синтез органических соединений.
Элементы группы 1 обладают характерными свойствами, обусловленными наличием одного электрона на внешней оболочке. Они легко образуют положительные ионы и имеют низкую энергию ионизации. При реакции с водой, щелочные металлы образуют щелочные растворы и выделяются водород.
Электронная оболочка металлов 1 группы
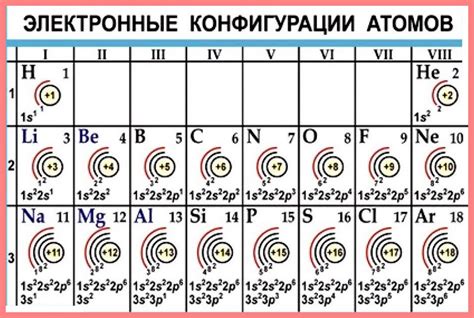
Металлы 1 группы периодической системы Менделеева относятся к щелочным металлам и состоят из элементов лития (Li), натрия (Na), калия (K), рубидия (Rb), цезия (Cs) и франция (Fr). Эти элементы имеют общую особенность в строении своей электронной оболочки, что объясняет их подобное химическое поведение.
Электронная оболочка металлов 1 группы имеет один электрон в s-подуровне последней энергетической оболочки. Это делает их очень реактивными металлами, способными активно взаимодействовать с другими элементами и образовывать стабильные и нестабильные соединения.
Все эти элементы имеют один электрон в валентной оболочке, который легко отдают, образуя положительный ион. Этот электронный конфигурация позволяет им образовывать соединения с отрицательно заряженными ионами, такими как кислород и сера, образуя стабильные соли.
Металлы 1 группы имеют характерные свойства, такие как низкая плотность и температура плавления, высокая реактивность и способность к образованию ионов. Они также хорошо проводят электричество и тепло, что делает их полезными материалами в различных областях, включая электротехнику и промышленность.
Электронная структура металлов 1 группы способствует их активной реактивности и химической активности. Они легко образуют стабильные и нестабильные соединения с другими элементами, в том числе с водой и кислородом, поэтому они обычно хранятся под слоем масла или хранятся в среде без доступа воздуха.
Структура электронной оболочки

Структура электронной оболочки металлов 1 группы характеризуется наличием одного электрона на внешней оболочке, что делает их химически активными. Внешний электрон представляет собой s-орбиталь, имеющую форму шара, располагающегося ближе к ядру атома металла.
Стоит отметить, что у металлов 1 группы, в отличие от других металлов, электронная оболочка содержит только один электрон на внешней s-орбитали. Это объясняет их высокую химическую активность. Взаимодействуя с другими элементами, металлы 1 группы с легкостью отдают свой внешний электрон, образуя положительный ион.
Структура электронной оболочки металлов 1 группы позволяет им образовывать соли, обладающие ярким окрасом. Это связано с тем, что при образовании ионов металлы из электронной оболочки металла поглощают энергию, излучаемую светом определенной длины волны, что придает соли определенный окрас.
Также следует отметить, что из-за своей высокой химической активности, металлы 1 группы редко встречаются в природе в свободном состоянии. Они образуют соединения с другими элементами и часто входят в состав рудных и минеральных образований, таких как галит, калийная соль и другие.
Внутренняя электронная оболочка

Внутренняя электронная оболочка атома металлов 1 группы представлена двумя электронными оболочками. Первая электронная оболочка, обозначаемая символом K, содержит два электрона, а вторая электронная оболочка, обозначаемая символом L, содержит восемь электронов. Всего во внутренней электронной оболочке атома металлов 1 группы находится 10 электронов.
Электроны в внутренней оболочке атома металлов 1 группы располагаются в энергетических уровнях, которые образуют субуровни s и p. Первая электронная оболочка, образующаяся энергетическими уровнями 1s, заполняется двумя электронами, а вторая электронная оболочка, образующаяся энергетическими уровнями 2s и 2p, заполняется восемью электронами.
Электроны в орбиталях субуровня s имеют меньшую энергию, поэтому они заполняются первыми. В первой электронной оболочке атома металлов 1 группы находится одна s-подобная орбиталь 1s, а во второй электронной оболочке находится две s-подобные орбитали: 2s и одна p-подобная орбиталь 2p. Электроны в этих орбиталях обладают частичным моментом импульса.
Внешняя электронная оболочка
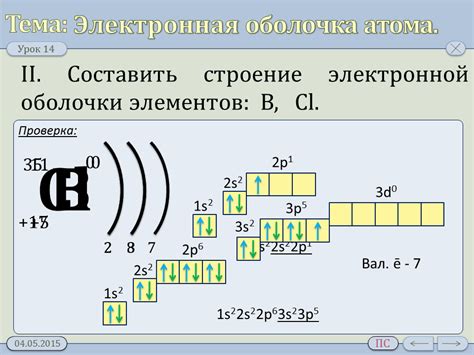
Внешняя электронная оболочка атома состоит из электронов, находящихся на самом дальнем от ядра энергетическом уровне. В случае металлов первой группы, внешняя оболочка содержит один электрон в s-орбитали. Такой электрон называется валентным и отвечает за химические свойства элемента.
Валентный электрон металлов первой группы находится на относительно большом расстоянии от ядра и слабо притягивается к положительно заряженному ядру. Поэтому эти металлы имеют высокую реакционную способность и легко вступают в химические реакции.
В связи с одним валентным электроном внешняя оболочка металлов первой группы начинается с одного s-орбиталя и содержит один электрон на этом орбитале. Схематически эта оболочка может быть представлена как одна точка на энергетическом уровне.
Валентный электрон обладает довольно большой энергией и легко переходит на более низкие энергетические уровни при взаимодействии с другими атомами. Это позволяет металлам первой группы проявлять металлические свойства, такие как хорошая электропроводность и теплопроводность.
Способы образования ионов

Ионы могут образовываться различными способами. Один из наиболее распространенных способов образования ионов - это процесс ионизации, при котором атом или молекула получает или теряет один или несколько электронов.
При ионизации металлов 1 группы, как, например, натрия, атомы теряют один электрон, образуя положительно заряженный ион Na+. Это происходит из-за наличия 1 электрона во внешней электронной оболочке, который слабо удерживается ядром атома. Такой ион называется катионом, поскольку он обладает положительным зарядом.
Некоторые металлы 1 группы, такие как литий и калий, способны образовывать не только однозарядные ионы, но и двухзарядные ионы. Например, литий может образовать ион Li+ и Li2+, в зависимости от количества потерянных электронов. Такие ионы называются двухзарядными катионами.
Также существует процесс образования отрицательно заряженных ионов, которые называются анионами. Одной из причин образования анионов является приобретение атомами или молекулами одного или нескольких электронов из окружающей среды. Например, хлор приобретает один электрон и образует ион Cl-, который имеет отрицательный заряд.
Таким образом, ионы могут образовываться путем потери или приобретения электронов атомами или молекулами. Это образование ионов является основой для многих химических реакций и процессов, происходящих веществами.
Химические свойства

Металлы 1 группы (щелочные металлы) обладают высокой химической активностью из-за наличия одного электрона на внешней электронной оболочке. Они легко вступают в химические реакции, образуя ионы положительного заряда.
На воздухе щелочные металлы быстро окисляются: нарезанные прутки натрия или калия покрываются оксидной пленкой и начинают гореть, образуя оксиды. Реакция с водой является одной из характерных реакций щелочных металлов. Они реагируют с водой, образуя щелочные гидроксиды и выделяя водород.
Металлы 1 группы образуют стабильные соединения с галогенами (фтором, хлором, бромом, йодом). В результате реакции образуются галогениды металлов, которые часто имеют ярко выраженный цвет. Кроме того, щелочные металлы реагируют с кислородом, серой, сероводородом и другими неметаллами.
Химическая активность щелочных металлов возрастает от лития к цезию. Литий – наименее активный металл, а цезий – наиболее активный. При этом химические свойства всех щелочных металлов имеют сходство, так как их внешняя электронная оболочка содержит всего один электрон.
Вопрос-ответ

Каким образом строится электронная оболочка металлов 1 группы?
Электронная оболочка металлов 1 группы строится по принципу заполнения энергетических уровней. Сначала заполняется 1s-орбиталь, затем 2s-орбиталь и, наконец, 2p-орбиталь.
Каково общее число электронов в электронной оболочке металлов 1 группы?
Общее число электронов в электронной оболочке металлов 1 группы равно 1 + 1 + 3 = 5. Это связано с тем, что первая группа включает элементы с 1 электроном на s-орбитали и 3 электронами на p-орбитали.
Какие элементы входят в металлы 1 группы?
В металлы 1 группы входят литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Все эти элементы являются щелочными металлами.
Почему электронная оболочка металлов 1 группы состоит из s- и p-орбиталей?
Электронная оболочка металлов 1 группы состоит из s- и p-орбиталей из-за их расположения в периодической системе химических элементов. Эти орбитали обладают наибольшей энергией и, следовательно, заполняются первыми при построении электронной оболочки.
Каково максимальное число электронов, которое может находиться на одной энергетической орбитали металлов 1 группы?
Максимальное число электронов, которое может находиться на одной энергетической орбитали металлов 1 группы, составляет 2. Каждая орбиталь может содержать не более 2 электронов с противоположными спинами по принципу Паули.
