Щелочные металлы представляют собой группу элементов, расположенных в первой группе периодической таблицы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они характеризуются низкой электроотрицательностью, что делает их активными металлами с высокой реакционной способностью.
Строение атомов щелочных металлов обладает некоторыми особенностями. Во-первых, они имеют простую электронную конфигурацию. Атомы щелочных металлов содержат один электрон в своей валентной оболочке, что делает их легко подверженными окислительно-восстановительным реакциям. Таким образом, они имеют тенденцию образовывать ион положительного заряда.
Во-вторых, атомы щелочных металлов характеризуются большим размером, так как у них низкая зарядовая плотность ядра. Это связано с их низкой электроотрицательностью и большим размером валентной оболочки. Этот факт имеет важное значение при реакциях с другими элементами, так как обмен электронами происходит на большом расстоянии.
Интересно отметить, что свойства щелочных металлов обусловлены их строением атомов. Реакционная способность связана с легкостью потери валентного электрона. Высокая активность и способность образовывать сильные основания являются результатом высокой реакционной способности щелочных металлов.
В заключение, строение атомов щелочных металлов обладает особенностями, определяющими их физические и химические свойства. Простая электронная конфигурация и большой размер валентной оболочки сказываются на химической активности этих элементов.
Свойства и структура атома щелочных металлов
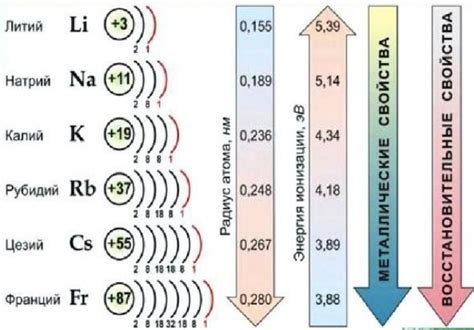
Щелочные металлы – это элементы группы 1 периодической системы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У атомов щелочных металлов есть свои особенности в структуре и свойствах, которые обусловлены их электронной конфигурацией и другими факторами.
Структура атома щелочных металлов включает ядро, в котором находятся протоны и нейтроны, а также электроны, движущиеся по орбитальным оболочкам. За счет малого количества электронов в внешней оболочке, щелочные металлы обладают химической активностью и свойствами.
Атомы щелочных металлов имеют одну электронную оболочку, называемую "s-оболочкой". Она может содержать 1 или 2 электрона, что определяет их химическую активность и способность образовывать ионные связи. Самым активным из щелочных металлов является франций, так как у него только один электрон на внешней оболочке.
Свойства щелочных металлов включают низкую температуру плавления и кипения, мягкость, а также высокую реакционную способность. Они легко окисляются и образуют ионы с положительным зарядом. Ионы щелочных металлов обладают большим радиусом и низкой полярностью, что определяет их растворимость в водах и других растворителях.
Свойства и структура атома щелочных металлов являются основой для их использования в различных областях, включая химическую промышленность, электрохимию, фармацевтику и даже в космической технологии. Понимание этих особенностей позволяет ученым создавать новые материалы и соединения с уникальными свойствами и применением.
Отличительные черты строения атома щелочных металлов

Строение атома щелочных металлов имеет несколько отличительных черт, которые отличают их от других элементов периодической таблицы.
Во-первых, атомы щелочных металлов имеют маленький размер и самый низкий атомный радиус среди всех элементов. Это объясняется тем, что у них всего один электрон в внешней оболочке, что приводит к компактному строению.
Во-вторых, эти элементы обладают низкой ионизационной энергией, то есть малое количество энергии требуется для удаления внешнего электрона из атома. Это связано с тем, что один электрон находится на большом удалении от положительного ядра, что делает его легкодоступным для внешних воздействий.
В-третьих, щелочные металлы имеют низкую энергию ионизации и высокую электроотрицательность. Это позволяет им легко образовывать ионы с положительным зарядом и проявлять хорошую реакционную способность.
Еще одной отличительной чертой строения атома щелочных металлов является их высокая атомная масса. Они находятся в первой группе периодической таблицы и имеют атомные номера от 3 до 11.
Кроме того, атомы щелочных металлов имеют свойство образования сильно поляризуемых атомов, что позволяет им обладать высокой электроотрицательностью и энергией ионизации.
Основные свойства щелочных металлов

Щелочные металлы - это группа химических элементов, обладающих рядом уникальных свойств. Основными характеристиками щелочных металлов являются:
- Активность и реактивность: Щелочные металлы являются самыми активными из всех химических элементов. Это связано с их низкой ионизационной энергией и способностью быстро отдавать электроны другим элементам. Благодаря этому, щелочные металлы легко реагируют с водой, кислородом и другими веществами.
- Мягкость и низкая плотность: Щелочные металлы обладают мягкой консистенцией и низкой плотностью. Например, литий - самый легкий металл в таблице Менделеева. Это позволяет легко разрезать щелочные металлы ножом или даже руками.
- Высокая электропроводность: Щелочные металлы обладают высокой электропроводностью благодаря своей структуре и наличию свободных электронов. Это делает их полезными для производства различных электронных устройств и батарей.
- Образование сильных оснований: Щелочные металлы легко реагируют с водой, образуя щелочные растворы. Эти растворы являются сильными основаниями и могут использоваться в различных промышленных процессах и в химических реакциях.
- Свойства катиона: Щелочные металлы образуют положительно заряженные ионы (катионы), которые обладают большим размером и малой полярностью. Это приводит к высокой растворимости щелочных металлов в воде и других растворителях, а также к образованию стабильных солей.
Электронная конфигурация атомов щелочных металлов

Электронная конфигурация атомов щелочных металлов определяет их химическую активность и свойства. Щелочные металлы находятся в первой группе периодической системы элементов и включают литий, натрий, калий, рубидий, цезий и франций.
Атомы щелочных металлов имеют общую особенность - внешний электронный уровень s-подуровня полностью заполнен одним электроном. Например, атом лития имеет конфигурацию 1s2 2s1, где 1s2 соответствует двум электронам на 1s-подуровне, а 2s1 - одному электрону на 2s-подуровне.
Атомы щелочных металлов имеют низкую ионизационную энергию, что делает их хорошими металлами, способными образовывать катионы. При этом, они легко отдают свой внешний s-электрон, образуя ионы с единичным положительным зарядом, что обуславливает их химическую активность.
Порядок заполнения электронных уровней следует правилу, в соответствии с которым электроны заполняют подуровни с наименьшей энергией. Атомы щелочных металлов имеют электронную конфигурацию с одним электроном на s-подуровне последнего энергетического уровня.
Химические свойства щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., обладают уникальными химическими свойствами, которые определяют их роль в химии и промышленности.
Одной из особенностей щелочных металлов является их высокая реактивность. В контакте с водой, щелочные металлы образуют щелочные растворы, как, например, гидроксиды лития (LiOH), натрия (NaOH) и калия (KOH). Эти растворы служат сильными щелочами и широко используются в различных процессах.
Однако, химическая реакция щелочных металлов с водой может протекать весьма интенсивно, с выделением больших количеств горючих газов. Более того, при контакте с влажным воздухом, щелочные металлы могут образовывать пирофорные соединения, которые могут самовозгораться при взаимодействии с кислородом воздуха.
Кроме того, щелочные металлы способны вступать в реакцию с рядом других веществ, в том числе с кислородом, серой, фосфором и многими органическими соединениями. Это обусловлено их большими электроотрицательностями и низкими энергиями ионизации.
Из-за своей высокой реактивности, щелочные металлы обычно хранят в смоляных или парафиновых соляных растворах, чтобы предотвратить их реакцию с влажным воздухом. Кроме того, они не хранятся совместно с кислородом и серой, чтобы избежать пожаро-взрывоопасной ситуации.
Физические свойства щелочных металлов

Плотность: Щелочные металлы обладают низкой плотностью. Например, литий имеет плотность всего 0,53 г/см³, калий - 0,86 г/см³, а цезий - 1,87 г/см³. Это делает их легкими и мягкими металлами, что придает им характерные свойства.
Точка плавления: У щелочных металлов низкая точка плавления. Например, литий плавится при температуре всего 180 °C, натрий - при 98 °C, а калий - при 63 °C. Это обусловлено слабой связью между атомами металла в кристаллической решетке.
Термоэлектрические свойства: Щелочные металлы обладают высокой термоэлектрической активностью. Они способны генерировать электрическую энергию при нагреве или охлаждении. Это свойство делает их важным материалом для производства термоэлектрических приборов и батарей.
Проводимость: Щелочные металлы отличаются хорошей электропроводностью. Их внешний электрон, находящийся в s-подуровне, легко двигается по кристаллической решетке и способен передавать электрический заряд. Это делает щелочные металлы хорошими проводниками электричества.
Оптические свойства: Щелочные металлы обладают хорошей оптической прозрачностью. Они поглощают и испускают свет в видимом диапазоне спектра, что делает их полезными в оптической технологии. Они также проявляют фотоэлектрические свойства, способные преобразовывать световую энергию в электрическую.
Поверхностные свойства: Щелочные металлы имеют хорошую адгезию к различным материалам. Их поверхность легко реагирует с воздухом и влагой, покрываясь коркой оксидов и гидроксидов. Из-за этого свойства щелочные металлы используются в производстве сплавов, покрытий и катализаторов.
Использование щелочных металлов в промышленности и научных исследованиях
Щелочные металлы, такие как литий, натрий, калий и др., являются важными компонентами во многих промышленных и научных отраслях. Их уникальные свойства делают их незаменимыми в различных областях применения.
Одной из основных областей, в которых используются щелочные металлы, является электротехника. Они активно применяются в производстве высокоэффективных аккумуляторов и батарей, которые широко используются в мобильных устройствах, автомобилях и солнечных батареях. Литий-ионные аккумуляторы, содержащие литий, натрий и калий, обладают большей энергоемкостью и показывают более стабильную работу по сравнению с другими типами аккумуляторов.
Еще один пример использования щелочных металлов - производство стекла. Натрий является основным компонентом стекла и придает ему прочность и прозрачность. Калий используется в производстве различных стеклянных изделий, таких как посуда, окна и фары для автомобилей.
В научных исследованиях щелочные металлы также имеют важное значение. Например, литий является одним из основных элементов в химическом анализе и используется в различных методах определения различных веществ. Калий используется в биологических исследованиях, таких как изучение роли и функций калиевых ионов в организмах.
В целом, щелочные металлы играют важную роль в различных отраслях, благодаря своим уникальным свойствам. Их использование в промышленности и научных исследованиях способствует развитию новых технологий и достижению новых научных открытий.
Вопрос-ответ

Какова основная структура и строение атомов щелочных металлов?
Атомы щелочных металлов имеют простую структуру и состоят из ядра, в котором находятся протоны и нейтроны, и облака электронов, вращающихся вокруг ядра по энергетическим уровням.
Какова электронная конфигурация атомов щелочных металлов?
Электронная конфигурация атомов щелочных металлов заключается в заполнении энергетических уровней электронами. Основной энергетический уровень щелочных металлов состоит из одной электронной оболочки, на которой находится один электрон. Внешняя электронная оболочка содержит один или два электрона.
Какие свойства атомов щелочных металлов определяют их химическую активность?
Щелочные металлы обладают высокой химической активностью из-за низкого энергетического уровня внешней электронной оболочки и большого размера этой оболочки. Это означает, что атомы щелочных металлов легко отдают свой внешний электрон, что делает их хорошими агентами окисления и реагентами в реакциях образования солей и соединений с другими элементами.
