Атомы щелочных металлов - это особые частицы, которые обладают уникальными свойствами. Щелочные металлы включают в себя элементы первой группы периодической системы, такие как литий, натрий, калий, рубидий и цезий. Каждый атом щелочного металла состоит из ядра, вокруг которого вращаются электроны.
Ядро атома щелочного металла содержит протоны и нейтроны. Протоны - это положительно заряженные частицы, которые определяют химические свойства элемента. Нейтроны не имеют заряда и не влияют на химическое поведение атома. Количество протонов и нейтронов в ядре определяет массовое число атома.
Вокруг ядра атома находятся электроны - негативно заряженные частицы. Число электронов в атоме равно числу протонов в ядре, что делает атом электрически нейтральным. Электроны располагаются на энергетических уровнях или орбитах, которые образуют электронные оболочки атома.
Строение атомов щелочных металлов обладает важными особенностями. Эти металлы имеют одну электронную оболочку, которая содержит только один электрон. Это делает их очень реакционноспособными, так как они стремятся потерять это электрон и стать ионами с положительным зарядом.
Строение атомов щелочных металлов представляет важную основу для понимания их химических свойств и влияния на окружающую среду. Эти элементы широко используются в различных отраслях, таких как промышленность, медицина и электроника. Изучение строения атомов щелочных металлов позволяет расширить наши познания о макроскопическом мире и помогает в создании новых материалов и технологий.
Определение и классификация
Атомы щелочных металлов представляют собой элементарные частицы, состоящие из протонов, нейтронов и электронов. Щелочные металлы включают в себя элементы первой группы периодической системы, а именно литий, натрий, калий, рубидий, цезий и франций. Каждый атом щелочного металла содержит один электрон в внешней энергетической оболочке, что делает их очень реактивными и склонными к образованию ионов.
Щелочные металлы можно классифицировать по своим свойствам и химическим реакциям. Например, литий и натрий обладают более низкими температурами плавления и кипения, чем остальные щелочные металлы. Калий, рубидий и цезий имеют более высокие плотности и более низкие точки плавления. Франций, на другой стороне, является самым редким и нестабильным щелочным металлом, и его свойства изучаются только в лабораторных условиях.
Щелочные металлы также отличаются своей реакционной способностью с водой и кислородом. Некоторые, такие как литий и натрий, реагируют с кислородом и водой, образуя оксиды и гидроксиды, а другие, такие как калий и цезий, могут прореагировать с воздухом, образуя окиси. Эти свойства классифицируют щелочные металлы как очень активные элементы, которые могут быть использованы в различных химических и физических процессах.
Электронная конфигурация
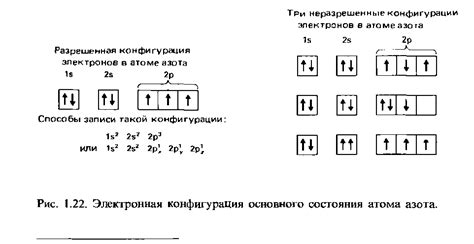
Электронная конфигурация атомов щелочных металлов определяет расположение и количество электронов в их электронных оболочках. Электронная конфигурация позволяет понять, какие уровни энергии и подуровни заполнены электронами.
Атомы щелочных металлов имеют одну электронную оболочку и внешнее электронное состояние s-блока. Все электроны в атомах этих металлов находятся на одном энергетическом уровне.
Например, натрий имеет электронную конфигурацию 1s^2 2s^2 2p^6 3s^1. Это означает, что в первой электронной оболочке находятся два электрона, во второй электронной оболочке - восемь электронов и в третьей электронной оболочке - один электрон на s-подуровне.
Благодаря своей электронной конфигурации, атомы щелочных металлов имеют склонность к потере внешнего электрона и образованию положительного иона, так как это позволяет достичь более стабильного электронного состояния.
Таким образом, электронная конфигурация играет важную роль в определении химических свойств и реакционной способности атомов щелочных металлов.
Ядро атома щелочного металла
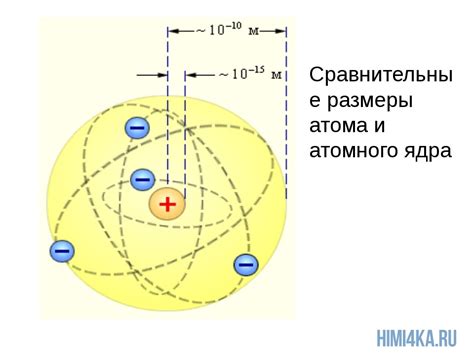
Ядро атома щелочного металла состоит из протонов и нейтронов, образуя ядерное зарядовое ядро. Протоны заряжены положительно, а нейтроны не имеют заряда. Это делает ядро атома щелочного металла положительно заряженным.
Количество протонов в ядре определяет атомный номер щелочного металла. Например, у лития атомный номер равен 3, что означает, что его ядро содержит 3 протона. Нейтроны имеют тенденцию содержаться в некотором количестве в ядрах атомов щелочного металла, но их количество может варьироваться в зависимости от изотопа металла.
Ядро атома щелочного металла является очень плотным и компактным. Оно окружено электронными облаками, которые образуют электронные орбитали или электронные оболочки. Электроны находятся на энергетических уровнях вблизи ядра и взаимодействуют с ним через электромагнитное взаимодействие.
Химические свойства

Щелочные металлы являются самыми активными химическими элементами, встречающимися в природе. Они обладают свойством легко окисляться и образовывать ионы положительно заряженных катионов.
Химические свойства щелочных металлов, таких как литий, натрий, калий, рубидий и цезий, обусловлены их электронной конфигурацией и наличием одного электрона в внешней энергетической оболочке с общей формулой ns1 (где n - главное квантовое число).
Эти металлы способны образовывать стабильные соединения с другими элементами. Соединения щелочных металлов, например, оксиды, гидроксиды, соли и аллегрование, обладают различной степенью растворимости в воде и имеют широкий спектр применений в химической промышленности.
Щелочные металлы также проявляют активность в реакциях с водой и влажным воздухом. При взаимодействии с водой они образуют гидроксиды и высвобождаются водород. Кроме того, они могут реагировать с кислородом из воздуха, образуя оксиды или пероксиды.
Химические свойства щелочных металлов также определяют их реактивность и способность образовывать соединения с другими элементами. Их электроположительные свойства позволяют им легко вступать в реакции с отрицательно заряженными относительно их катионов анионами.
Вопрос-ответ

Каково строение атомов щелочных металлов?
Строение атомов щелочных металлов является открытой электронной структурой, что означает, что на внешней энергетической оболочке у них находится только один электрон. Это делает их очень реактивными и склонными к образованию ионов положительного заряда.
Почему в атомах щелочных металлов только один электрон на внешней оболочке?
На внешней оболочке атомов щелочных металлов находится только один электрон, потому что атомы этих металлов имеют одну энергетическую оболочку с низкой энергией, которая может вместить только один электрон. Это делает их нестабильными и склонными к реакциям с другими веществами.
Какая электронная структура у атомов щелочных металлов?
У атомов щелочных металлов электронная структура состоит из двух оболочек: первая оболочка содержит 2 электрона, а вторая оболочка содержит 8 электронов и один электрон на внешней оболочке. Это обуславливает особенности их химического поведения и высокую реактивность.
