Металлы представляют собой разнообразную группу элементов, обладающих уникальными физическими и химическими свойствами. Одним из ключевых аспектов их строения является особенное устройство атомов металлов.
Атом металла состоит из ядра, которое содержит протоны и нейтроны, а также электронов, движущихся по орбитам вокруг ядра. Но в отличие от атомов других элементов, атомы металлов имеют несколько особенностей в своем строении.
Во-первых, у атомов металлов обычно очень мало электронов на внешней оболочке сравнительно с числом электронов внутренних оболочек. Поэтому металлы имеют тенденцию отдавать электроны и образовывать положительно заряженные ионы, которые в дальнейшем могут образовывать кристаллическую решетку.
Во-вторых, атомы металлов имеют общую особенность – они могут образовывать связи друг с другом. Благодаря этому особому свойству металлы образуют кристаллическую решетку или сетку, в которой атомы металлов расположены регулярно и упорядочено.
Таким образом, особенности строения атомов металлов, такие как относительно небольшое количество электронов на внешней оболочке и возможность образования связей между атомами, определяют уникальные свойства металлических материалов – их прочность, пластичность и электропроводность.
Строение атомов металлов
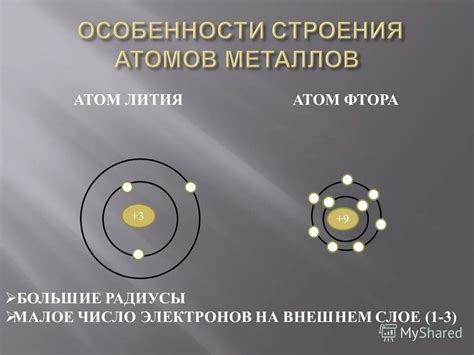
Атомы металлов отличаются от атомов других элементов своим строением и особыми свойствами. Они имеют основу в виде ядра, в котором находятся протоны и нейтроны.
Особенностью атомов металлов является их электронная оболочка. Электроны в атомах металлов располагаются в нескольких энергетических уровнях, образуя электронные облака различной формы и размера.
Главное отличие атомов металлов заключается в наличии у них свободных электронов. Уровень заполненности внешней электронной оболочки атома металла может быть меньше максимального, что делает это возможным. Свободные электроны, находящиеся в облаке вокруг ядра, обладают высокой подвижностью и являются основной причиной металлической проводимости.
Благодаря наличию свободных электронов, атомы металлов образуют кристаллическую решетку, которая обладает высокой прочностью и способностью к теплопроводности. Кристаллическая решетка обусловливает такие свойства металлов, как пластичность и обработаемость.
Для наглядного представления строения атомов металлов можно использовать таблицу Менделеева:
| Элемент | Символ | Атомная масса |
|---|---|---|
| Медь | Cu | 63,55 |
| Железо | Fe | 55,85 |
| Алюминий | Al | 26,98 |
Таким образом, строение атомов металлов отличается от строения атомов других элементов своей электронной оболочкой и наличием свободных электронов. Это позволяет металлам обладать такими свойствами, как проводимость электричества и тепла, прочность и пластичность.
Состав металлических атомов

Металлический атом представляет собой особую структуру, состоящую из ядра и электронной оболочки. Ядро атома образовано протонами и нейтронами, которые находятся внутри атома и обладают положительным зарядом. Протоны несут единичный плюсовой заряд, а нейтроны не имеют заряда и являются нейтральными частицами.
Электронная оболочка атома, в свою очередь, состоит из электронов – частиц с отрицательным зарядом. Электроны обращаются по определенным энергетическим уровням, которые называются электронными оболочками или энергетическими уровнями. Первая электронная оболочка вмещает не более 2 электронов, вторая – не более 8, третья – не более 18 и т.д.
Металлы обладают интересной особенностью – свободными электронами. Это значит, что у них внешняя электронная оболочка не заполнена полностью и наличие свободных электронов позволяет металлам проявлять свои основные свойства, такие как теплопроводность, электропроводность и пластичность.
Свободные электроны в металлическом атоме формируют так называемое "море электронов", которое связывает атомы металла внутри кристаллической решетки. Этот "море электронов" является ответственным за передачу тепла и электричества в металлах, а также за возможность металлов легко принимать форму и изменять свою структуру без растрескивания.
Электрические свойства металлических атомов

Металлические атомы обладают особыми электрическими свойствами, которые делают металлы отличными проводниками электричества.
Главной особенностью электрических свойств металлических атомов является наличие свободных электронов. В металлах электроны внешних энергетических уровней не тесно связаны с конкретными атомами, а вместо этого образуют общий электронный облако. Это облако состоит из свободных электронов, которые могут передвигаться по всему металлу.
Именно наличие свободных электронов позволяет металлам проявлять свои электрические свойства. Металлические атомы способны проводить электрический ток, так как свободные электроны могут двигаться под воздействием внешнего электрического поля. Это объясняет хорошую электропроводность металлов и возможность использования их в различных приборах и проводниках.
Количество свободных электронов в металле определяет его электрические свойства. Чем больше свободных электронов, тем лучше металл проводит электрический ток. Также влияет и их подвижность – способность перемещаться под воздействием электрического поля. Высокая подвижность свободных электронов делает металлы эффективными проводниками.
В заключение, электрические свойства металлических атомов определяются наличием свободных электронов и их способностью передвигаться по металлической решетке. Эти свойства делают металлы идеальными материалами для создания проводников электричества.
Физические характеристики металлических атомов

Атомы металлов обладают рядом физических характеристик, которые отличают их от атомов других элементов. Во-первых, у металлических атомов высокая плотность и теплопроводность. Это связано с их особенной структурой и упаковкой атомов в кристаллической решетке.
Во-вторых, металлические атомы обладают высокой электропроводностью. Это происходит из-за наличия свободных электронов в зоне проводимости, которые могут свободно перемещаться под действием электрического поля.
Также металлические атомы обладают специфическими оптическими свойствами. Они способны поглощать и отражать свет различных длин волн, что определяет их металлический блеск. Некоторые металлы, такие как золото и серебро, обладают высокой истинной отражательной способностью, что делает их ценными материалами для ювелирных изделий и зеркал.
В то же время, металлические атомы обладают высокой теплоемкостью. Это означает, что им требуется большое количество энергии для нагрева и охлаждения. Такая особенность делает металлы хорошими материалами для конструкций, так как они способны удерживать тепло в течение длительного времени.
Кроме того, атомы металлов имеют большую массу и атомный радиус по сравнению с атомами других элементов. Это объясняется наличием большего количества электронных оболочек и более тяжелых ядер в металлических атомах.
Взаимодействие металлических атомов с другими элементами

Металлы являются химическими элементами, которые обладают способностью образовывать ионные или ковалентные связи с другими элементами. Взаимодействие металлических атомов с другими элементами может приводить к образованию различных химических соединений.
Одним из наиболее распространенных способов взаимодействия металлических атомов с другими элементами является ионный обмен. В этом случае металлический атом отдает или получает электроны, образуя положительные ионы, которые могут связываться с отрицательно заряженными ионами других элементов.
Кроме ионного обмена, металлические атомы также могут образовывать ковалентные связи с другими элементами. В этом случае атомы обмениваются парами электронов, создавая совместно используемые электроны для образования связей. Такие связи обычно образуются между атомами металла и неметалла.
Взаимодействие металлических атомов соединениями неметаллов может приводить к образованию различных веществ, таких как соли, оксиды, гидриды и т.д. Например, когда металлический атом взаимодействует с атомом хлора, образуется хлорид металла. Эти соединения обладают определенными химическими и физическими свойствами, которые делают их полезными в различных областях, таких как промышленность, электроника и медицина.
Вопрос-ответ

Каким образом устроен атом металла?
Атом металла состоит из положительно заряженного ядра и облака электронов, которые образуют оболочки вокруг ядра.
Какие особенности есть в строении атомов металлов?
Основными особенностями в строении атомов металлов являются наличие большого количества электронов в последних энергетических оболочках и наличие свободных электронов, которые могут перемещаться между атомами, образуя так называемое "море электронов".
