Структура атомов металлов является основным фактором, определяющим их физические и химические свойства. Одним из ключевых элементов структуры атома металлов является внешний электронный слой, который играет важную роль во взаимодействии металлов с другими веществами и в формировании химических связей.
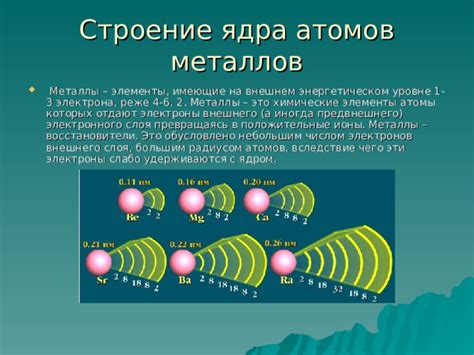
Внешний электронный слой атома металла состоит из валентных электронов, которые находятся на самых дальних энергетических уровнях от ядра. Валентные электроны обладают наибольшей энергией и участвуют в химических реакциях, обеспечивая возможность образования связей с другими атомами. Количество валентных электронов определяется порядковым номером элемента в периодической системе Менделеева и может варьироваться от одного до восьми.
Особенностью атомов металлов является наличие валентных электронов в нескольких энергетических оболочках. Это связано с особенностями строения энергетических уровней и распределения электронов в атоме. Валентные электроны обладают свободными или полу-связанными электронами и способны передвигаться внутри кристаллической решетки металла. Это объясняет металлическую проводимость и способность металлов образовывать ионные решетки и аллойсы с другими веществами.
Атомы металлов: структура и свойства
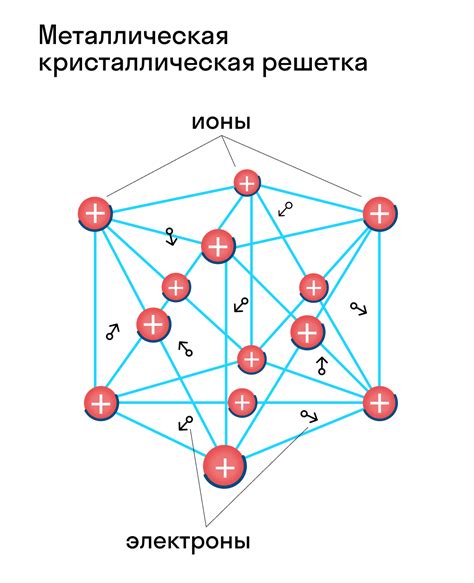
Атомы металлов обладают особенностями в своей структуре, которые определяют их уникальные свойства. Во-первых, у металлов внешний электронный слой содержит мало электронов по сравнению с другими элементами, что делает их хорошими проводниками электричества и тепла.
Структура атомов металлов характеризуется наличием металлической сетки, состоящей из положительно заряженных ионов металла и свободно движущихся электронов. Эти электроны образуют так называемое "море электронов", которое даёт металлам способность проводить электрический ток и обладать высокой электропроводностью.
В связи с этим, металлы имеют такие свойства, как высокая теплопроводность и теплоемкость. Энергия электронов в металлической сетке менее зависит от температуры, чем у других элементов, что объясняет способность металлов эффективно отводить тепло.
Свойства металлов также связаны с высокой пластичностью и прочностью, которые обусловлены деформацией металлической сетки при воздействии механических сил. Именно поэтому металлы широко используются в промышленности для производства различных конструкций, оборудования и изделий.
Кроме того, атомы металлов обладают способностью образовывать катионы, что определяет их химическую активность и способность образовывать соединения с другими элементами. Металлы часто обладают высокой реакционной способностью и могут образовывать разнообразные химические соединения, в том числе с неметаллами.
Внутренний электронный слой атомов металлов
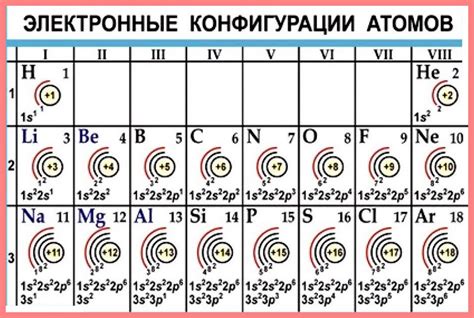
Внутренний электронный слой атомов металлов состоит из залов, заполненных электронами. Залы называются K, L, M и т.д. и обозначаются буквами алфавита. Каждый зал имеет определенное число электронов, которое определяется его номером.
Внутренний электронный слой атомов металлов представляет собой область пространства, в которой находятся электроны с наиболее низкой энергией. Каждый зал может содержать максимальное количество электронов, определяемое формулой 2n^2, где n - номер зала.
Так, например, первый зал K может содержать не более 2 электронов, второй зал L - не более 8 электронов, третий зал M - не более 18 электронов и так далее. Количество электронов внутреннего электронного слоя атома металла определяет его электронную конфигурацию и химические свойства.
Внутренний электронный слой атомов металлов является стабильным и плотно заполненным, что придает металлам их характерные свойства, такие как металлический блеск, хорошая теплопроводность и электропроводность. Внешний электронный слой атомов металлов, обычно состоящий из нескольких электронов, определяет их химическую активность и способность образовывать ионы и химические соединения.
Внешний электронный слой атомов металлов
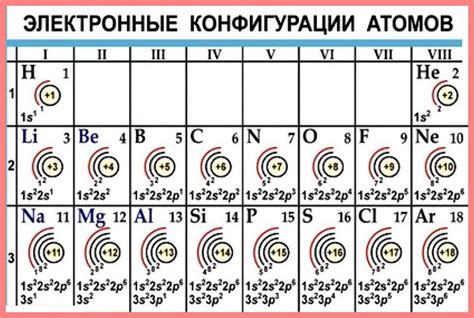
Структура атомов металлов отличается особенностями внешнего электронного слоя.
Внешний электронный слой атома металла состоит из валентных электронов, которые находятся на самой наружной энергетической оболочке. Они имеют наименьшую энергию и легко участвуют в химических реакциях. Количество валентных электронов определяет химические свойства металлов.
Металлы имеют малое количество валентных электронов, что делает их химически активными. Обычно у металлов валентный слой содержит от 1 до 3 электронов. Это обуславливает их способность образовывать положительные ионы.
Валентные электроны в атомах металлов обладают высокой подвижностью, что позволяет металлам проводить электрический ток. Это одно из ключевых свойств металлов и объясняется особенностями их электронной структуры.
Также внешний электронный слой металлов определяет их способность образовывать межатомные связи. Валентные электроны могут обмениваться или привлекаться друг к другу, что приводит к образованию кристаллической решетки в металлах.
Суммируя вышесказанное, внешний электронный слой атомов металлов играет ключевую роль в определении их химических и физических свойств. Валентные электроны обладают особыми характеристиками и позволяют металлам проявлять свою химическую активность, электропроводность и способность образовывать межатомные связи.
Особенности взаимодействия внешнего электронного слоя атомов металлов
Внешний электронный слой атома металла играет ключевую роль в его химических свойствах и взаимодействии с другими веществами. В отличие от валентных электронов, которые могут участвовать в химических реакциях, внешние электроны атомов металлов обладают большей подвижностью и могут образовывать электронные облака, называемые электронным газом.
Одной из особенностей взаимодействия внешнего электронного слоя атомов металлов является их способность образовывать межатомные связи, обеспечивающие прочность и металлический блеск. Это связано с тем, что внешние электроны свободно двигаются между атомами, образуя так называемую "плавающую электронную модель".
Интересно отметить, что именно внешний электронный слой атомов металлов определяет их проводимость электричества. Благодаря свободному движению электронов, атомы металлов могут легко передавать электронные заряды, что делает их отличными проводниками электричества.
Внешний электронный слой атомов металлов также играет важную роль в их теплопроводности. Благодаря свободному движению электронов, тепловая энергия может передаваться быстро и эффективно между атомами, что обуславливает высокую теплопроводность металлов.
В заключение, внешний электронный слой атомов металлов обладает особыми свойствами, которые определяют их химические и физические свойства. Эти свойства обеспечивают металлам их уникальные характеристики и делают их незаменимыми в множестве промышленных и технологических процессов.
Роль внешнего электронного слоя в химических свойствах металлов
Внешний электронный слой играет ключевую роль в определении химических свойств металлов. Эти свойства в значительной мере зависят от доступности электронов для взаимодействия с другими атомами или ионами.
У металлов внешний электронный слой обычно состоит из одного или нескольких энергетических уровней, на которых находятся свободные электроны, называемые электронами проводимости. В такой структуре атомов металлов электроны могут свободно двигаться по всей сетке кристаллической решетки, образуя облако электронов.
Именно благодаря наличию свободных электронов, металлы обладают высокой теплопроводностью и электропроводностью. Свободные электроны способны транспортировать энергию и заряд через металл, что делает их хорошими проводниками тепла и электричества.
Внешний электронный слой также определяет способность металла вступать в химические реакции. Свободные электроны могут участвовать в обмене электронами с другими атомами или ионами, что позволяет металлам образовывать соединения.
Кроме того, внешний электронный слой влияет на физические свойства металлов, такие как пластичность, твердость и плавление. Взаимодействие свободных электронов с атомами в решетке придаёт металлам специфическую структуру и свойства.
В целом, внешний электронный слой металлов играет решающую роль в их химических и физических свойствах. Он определяет электропроводность, способность к химическим реакциям и обеспечивает уникальные свойства металлов, которые делают их неотъемлемой частью современной промышленности и нашей повседневной жизни.
Вопрос-ответ

Как строится внешний электронный слой атомов металлов?
Внешний электронный слой атома металла строится из электронов, находящихся на самом удаленном от ядра энергетическом уровне. Это слой, который наиболее активно участвует в химических реакциях и определяет химические свойства металла.
Какие особенности есть у внешнего электронного слоя атомов металлов?
Основные особенности внешнего электронного слоя атомов металлов - это наличие незанятых энергетических уровней (внутренних отсеков) и наличие свободных электронов, которые могут свободно перемещаться по всей структуре кристаллической решетки металла.
Как внешний электронный слой атомов металлов влияет на их проводимость?
Внешний электронный слой атомов металлов обладает особой структурой и состоянием, которые позволяют электронам свободно двигаться внутри металлической сетки. Это обеспечивает электропроводность металлов и является одной из их основных характеристик.
Какие свойства химической связи у металлов обусловлены особенностями внешнего электронного слоя?
Особенности внешнего электронного слоя атомов металлов обусловливают такие свойства химической связи, как формирование металлической связи (мягкость, пластичность, хорошая электропроводность и теплопроводность) и формирование ионной связи с другими элементами при образовании металлических соединений.
