Атомы металлов — это особый тип атомов, которые обладают специфическим строением и свойствами. В отличие от атомов неметаллов, у атомов металлов нарушена электронная оболочка и доминирующие электроны заполняют внутренние энергетические уровни. Это приводит к образованию устойчивых катионов, которые играют важную роль в металлической связи.
Металлическая связь — это особый тип связи между атомами в металлах. Её основу составляют удалённые электроны, которые свободно перемещаются по всему металлическому кристаллу. Эти электроны называются электронами проводимости и отвечают за характерные свойства металлов, такие как электропроводность, теплопроводность и пластичность.
Ключевым элементом металлической связи является наличие у металлов большого количества подвижных электронов, готовых к перемещению. В результате этой связи между атомами, формируется структура, в которой положительно заряженный металлический ион окружен облаком отрицательно заряженных электронов. Это облако электронов придает металлам латунку и благодаря этому они способны проявлять свои физические и химические свойства.
В результате металлической связи атомы металла объединяются в кристаллическую решетку, где каждый атом окружен несколькими соседними атомами. Это обеспечивает прочность и устойчивость металлов, а также их способность выдерживать большие нагрузки и деформации без разрушения.
Металлы обладают высокой теплопроводностью и электропроводностью благодаря свободному движению электронов проводимости. Они могут легко восстанавливать свою форму после деформации, что делает их идеальными для использования в различных промышленных отраслях. Кроме того, свободные электроны могут передавать энергию в виде тепла и электричества, что делает металлы одними из наиболее эффективных проводников энергии.
В результате, строение атомов металлов и металлическая связь объясняют важные физические и химические свойства металлов, делают их основными строительными материалами многих индустрий и играют ключевую роль в их функционировании.
Строение атомов металлов
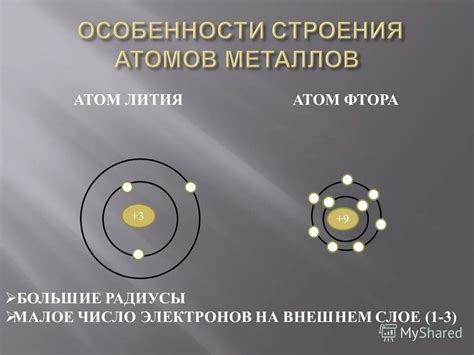
Атомы металлов имеют особенное строение, которое делает их уникальными и позволяет образовывать металлическую связь. Одной из главных особенностей атомов металлов является наличие большого количества электронов. Обычно внешний электронный слой атома металла содержит небольшое количество электронов, которые легко переходят от одного атома к другому.
Стоит отметить, что эти свободные электроны в атомах металлов обладают высокой подвижностью и могут свободно двигаться по металлической структуре. Это обусловлено наличием множественных валентных состояний энергии и слабой привязанностью электронов к отдельным атомам.
Также необходимо отметить, что атомы металлов имеют определенную геометрическую структуру, которая обеспечивает упорядоченное расположение атомов в кристаллической решетке. Обычно в металлах атомы располагаются в решетке, которая состоит из положительно заряженных ядер атомов и нейтральных электронных облаков.
Столь упорядоченная структура атомов металлов позволяет образовывать множество кристаллических структур с различными свойствами и характеристиками. Это объясняет множество свойств металлов, таких как электрическая и теплопроводность, пластичность, механическая прочность и другие.
Что такое атом?
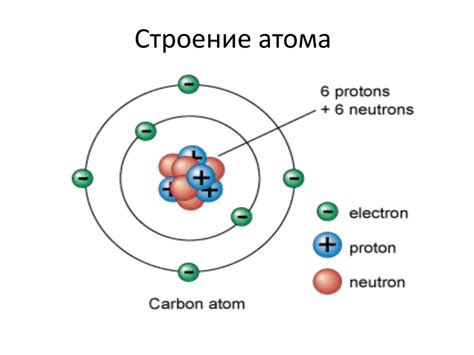
Атом - это наименьшая частица вещества, которая обладает химическими свойствами элемента. В основе атома лежит ядро, которое состоит из протонов с положительным зарядом и нейтронов без заряда. Вокруг ядра находятся электроны с отрицательным зарядом, движение которых образует облако электронов. Количество протонов и электронов в атоме обычно равно, что делает его электрически нейтральным.
Атомы объединяются между собой, образуя молекулы. В зоне перекрытия облак электронов одного атома вступает во взаимодействие с облаком электронов другого атома, образуя химическую связь. Внутри атома пространство заполнено электронами, которые образуют энергетические орбитали. Каждая орбиталь может содержать определенное количество электронов в соответствии с правилами заполнения.
Организация электронов в атоме определяет его электронную конфигурацию, которая влияет на химические свойства элемента. В зависимости от количества электронов на внешней энергетической орбитали, атом может быть реакционноспособным или инертным. Реакционноспособные атомы стремятся завершить свою внешнюю энергетическую орбиталь путем обмена или перекрытия электронами с другими атомами, что приводит к образованию химических связей и образованию молекул.
Электронная оболочка атома

Электронная оболочка атома является внешней частью атома, которая содержит электроны. Она состоит из энергетических уровней или орбиталей, на которых располагаются электроны.
Каждый энергетический уровень может содержать определенное количество электронов, соответствующее его вместимости. Энергетические уровни разделены на подуровни, которые имеют формы s, p, d, f и могут содержать разное количество электронов.
Электроны размещаются в электронных оболочках в соответствии с принципом заполнения: сначала заполняются энергетически низкие уровни, а затем высокие. Электроны также подчиняются принципу парности: на каждом энергетическом уровне должно быть не более двух электронов с противоположным спином.
Атомы стремятся достичь стабильности, заполняя свою внешнюю электронную оболочку. Для этого они могут образовывать химические связи с другими атомами, чтобы обменять электроны и заполнить недостающие уровни.
Ядро атома и его составляющие
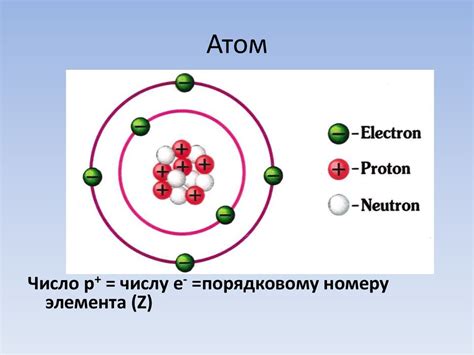
Ядро атома является его центральной частью и содержит большую часть его массы. Оно состоит из протонов и нейтронов, которые называются нуклонами. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда. Вместе они обеспечивают ядро атома его стабильностью и массой.
Протоны, находящиеся в ядре атома, определяют его атомный номер и указывают на его химические свойства. Число нейтронов в ядре может варьироваться, что приводит к образованию изотопов одного и того же элемента. Изотопы могут иметь различные физические свойства, такие как радиоактивность.
Ядро атома можно представить в виде таблицы, где в одной строке указаны виды нуклонов и их количество. Например, для атома кислорода атомный номер равен 8, что означает наличие в ядре 8 протонов. Общее количество нуклонов (протоны + нейтроны) определяет атомную массу. В случае кислорода общее количество нуклонов равно 16.
Важно отметить, что электроны, находящиеся в облаке вокруг ядра, не включаются в его состав. Они обладают отрицательным электрическим зарядом и принимают участие в химических реакциях, образуя химическую связь с другими атомами.
Металлическая связь

Металлическая связь - особый вид химической связи, характерный для металлов. Она обеспечивает прочность и металлические свойства вещества.
Основными характеристиками металлической связи являются подвижность электронов и положительная ионная решетка.
В металлической связи электроны свободно передвигаются по всему объему металла. Они образуют электронное облако, которое окружает положительно заряженные ионы металла. Такие электроны называются "свободными" или "электронами проводимости".
Металлическая связь обеспечивает металлам такие уникальные свойства как высокая теплопроводность, электропроводность, пластичность и металловидность. Это связано с подвижностью электронов и их способностью передавать энергию и тепло от одного атома к другому.
Причина подвижности электронов в металлической связи заключается в положительно заряженной ионной решетке, которая притягивает электроны и удерживает их вблизи ионов. Однако, ионы не являются неподвижными, они могут располагаться в различных положениях и деформироваться при воздействии внешних факторов.
В целом, металлическая связь является основой для объяснения множества физических и химических свойств металлов и их соединений. Она облегчает понимание поведения металлов в различных условиях и находит применение в различных областях науки и техники.
Понятие металлической связи

Металлическая связь – это особый тип химической связи, характерный для металлов. Он обусловлен специфическим строением атомов металла и их взаимодействиями.
Атомы металла в кристаллической решетке образуют сетку положительно заряженных ионов, которая окружает свободные электроны. Каждый атом металла отдает один или несколько своих внешних электронов в общее «море» свободных электронов. Это создает особую систему электронного переноса, которая лежит в основе металлической связи.
Свободные электроны перемещаются свободно по сетке положительно заряженных ионов, не привязанных к конкретному атому. Такая свобода движения электронов является основной причиной многих характерных свойств металлов.
Металлическая связь обладает рядом особенностей. Она обеспечивает хорошую электрическую и теплопроводность, так как свободные электроны могут легко перемещаться и передавать энергию. Кроме того, металлическая связь отвечает за блеск, пластичность и формоизменяемость металлов.
Металлическая связь имеет ключевое значение в различных технологических процессах и применяется в производстве металлургических материалов и металлообработке.
Механизм металлической связи
Металлическая связь является основной формой химической связи в металлах. Она обусловлена особенностями строения атомов металлов и их электронной структуры. В отличие от ковалентной или ионной связи, металлическая связь характеризуется тем, что электроны в металле не принадлежат отдельным атомам, а свободно движутся внутри металлической решетки.
Механизм металлической связи можно объяснить с помощью модели "электронного облака". Она предполагает, что в металле атомы образуют кристаллическую решетку, в которой положительно заряженные ядра атомов окружены областями, содержащими свободные электроны. Эти свободные электроны образуют так называемое "электронное облако", которое распространяется по всей металлической решетке, связывая атомы вместе.
Механизм металлической связи обеспечивает металлам ряд уникальных свойств. Одно из них — высокая электропроводность. Благодаря свободным электронам, связанным с ядрами атомов, металлы могут проводить электрический ток без значительного сопротивления. Кроме того, металлы обладают высокой теплопроводностью, так как свободные электроны могут передавать тепловую энергию между атомами.
Механизм металлической связи также объясняет хорошие механические свойства металлов, такие как пластичность и деформируемость. В металлической решетке свободные электроны могут свободно передвигаться, что позволяет атомам металла смещаться друг относительно друга без разрушения связи. Это делает металлы гибкими и пластичными, что позволяет им быть использованными в различных областях, начиная от строительства до электроники.
Особенности металлической связи
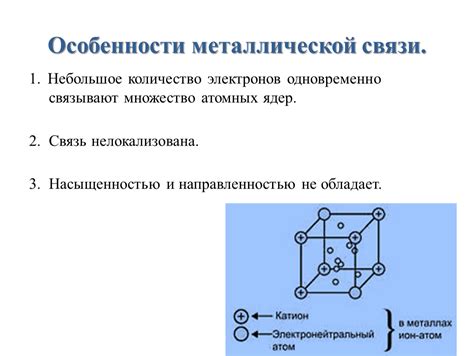
Металлическая связь имеет ряд особенностей, которые отличают ее от других видов связи. В основе металлической связи лежит свободное движение электронов между атомами металла. Это связано с особенной структурой атомов металлов.
Атомы металлов обладают одним или несколькими валентными электронами, которые слабо привязаны к ядру. При образовании металлической связи эти электроны образуют "облако" свободных электронов, которое окружает положительно заряженные ионные ядра атомов металла.
Благодаря свободному движению электронов, металлы обладают такими свойствами, как отличная проводимость электрического тока и тепла, а также металлический блеск. Электроны могут переносить энергию и информацию в виде свободных зарядов, позволяя металлам быть хорошими проводниками.
Кроме того, металлическая связь обладает высокой пластичностью и малой твердостью. Это связано с тем, что свободные электроны позволяют атомам перемещаться относительно друг друга без значительного нарушения структуры металлической решетки. Это объясняет способность металлов к неупругости и деформации без разрушения.
Таким образом, металлическая связь обладает уникальными свойствами, которые определяют характеристики и применение металлических материалов в различных областях науки и техники.
Вопрос-ответ

Какие особенности в строении атомов металлов?
Основными особенностями строения атомов металлов являются наличие внешней оболочки, состоящей из свободно движущихся электронов, и малое количество энергии, необходимое для удаления этих электронов из атома.
Как объясняется металлическая связь?
Металлическая связь объясняется наличием свободно движущихся электронов в внешней оболочке атомов металлов. Эти электроны образуют так называемое "облако свободных электронов", которое окружает положительно заряженные ядра металлических атомов. Это позволяет электронам свободно передвигаться внутри металла и создает прочную связь между атомами.
Почему электроны в металлах могут двигаться свободно?
У электронов в металлах есть так называемая "металлическая свобода". Это связано с тем, что электроны находятся в условиях малой энергии кристаллической решетки металла и свободно движутся внутри "облака свободных электронов". Кроме того, металлические атомы имеют малое количество энергии, необходимое для удаления электрона из атома.
