Металлы – это одна из основных групп веществ, выделяющихся своими особыми свойствами и широким применением в различных областях промышленности и научных исследований. Уникальные характеристики металлов обусловлены их строением на атомарном уровне.
Строение атомов металлов отличается от строения атомов неметаллов. В отличие от неметаллов, атомы металлов имеют относительно небольшое число валентных электронов, их химические связи отличаются от ковалентных или ионных связей, присущих неметаллам.
Наиболее характерной особенностью строения атомов металлов является так называемая металлическая связь. Металлическая связь возникает благодаря наличию свободных электронов в кристаллической решетке металла. Атомы металлов в кристаллическом состоянии образуют упорядоченную структуру, в которой позитивно заряженные ядра атомов окружены облаком свободных электронов.
Структура атомов металла
Атомы металла обладают особенной структурой, которая обусловливает их специфические свойства и способность образовывать металлическую связь.
В центре атома располагается ядро, состоящее из протонов и нейтронов. Протоны имеют положительный электрический заряд, в то время как нейтроны не обладают зарядом. Вокруг ядра электронные облака, состоящие из электронов, которые имеют отрицательный заряд.
Особенностью атомов металла является то, что в их внешней оболочке находится малое количество электронов. Эти электроны могут свободно перемещаться между атомами, создавая так называемые "электронные облака". Такая способность атомов металла к перемещению электронов обуславливает возможность образования металлической связи.
В результате образования металлической связи происходит общее перемещение электронов между всеми атомами металла, образуя электронное облако, которое характеризуется высокой подвижностью. Это облако электронов является причиной того, что металлы обладают высокой электропроводностью и теплопроводностью.
Благодаря своей специфической структуре, атомы металла находятся в тесном контакте друг с другом, образуя кристаллическую решетку. В результате этого металлы обладают высокой прочностью и пластичностью, а также способностью сохранять форму под воздействием внешних нагрузок.
Внешняя электронная оболочка
Внешняя электронная оболочка атома металла играет важную роль в формировании металлической связи. В отличие от электронных оболочек атомов других элементов, внешняя оболочка атомов металла содержит мало электронов или даже полностью заполнена. Именно эти свободные или слабосвязанные электроны, называемые валентными электронами, отвечают за реакционную способность и химические свойства металлов.
У атомов металла внешняя электронная оболочка может содержать от одного до нескольких электронов валентной оболочки. Эти валентные электроны являются подвижными и свободно перемещаются по кристаллической решетке металла. Благодаря своей подвижности, валентные электроны приобретают металлические свойства: способность проводить электрический ток и тепло.
Валентные электроны образуют так называемое "море" электронов. Свободные электроны отсутствуют в ближайших атомах, они перемещаются по всей металлической решетке, создавая слабое притяжение с положительными ионами атомов металла. Именно это взаимодействие между свободными электронами и положительно заряженными ионами атомов металла обеспечивает металлическую связь и характерные свойства металлов.
Ядро атома металла
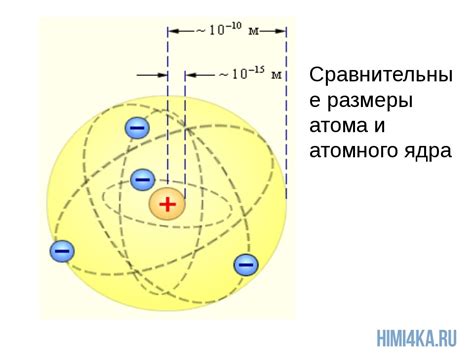
Ядро атома металла представляет собой центральную часть атома, содержащую протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны – нейтральный. Общая сумма зарядов протонов равна заряду электронов, находящихся в облаке вокруг ядра.
Масса ядра атома металла, как правило, превышает массу электронов в несколько тысяч раз. Поэтому, даже в небольшом атоме металла, ядро занимает очень небольшой объем, но имеет значительную массу. Ядро является самой плотной и стабильной частью атома металла.
Ядро атома металла обладает высокой плотностью заряда. Это связано с тем, что протоны, находящиеся в ядре, практически не могут перемещаться из-за своей массы и притяжения соседних протонов. Благодаря этому, ядро обладает большой плотностью заряда и представляет собой центр сильного притяжения для электронов.
Металлическая связь

Металлическая связь - это тип химической связи, характерный для металлов. В отличие от ковалентной или ионной связи, металлическая связь не ограничена между отдельными атомами, а распространяется на всю металлическую структуру.
Основной особенностью металлической связи является общая сеть электронов, так называемая "электронная облакон". Электроны связи перемещаются внутри этой облаконедвижением свободных электронов в металле, что придаёт ему многие из его характерных свойств.
Структура металла представляет собой решетку положительно заряженных металлических ионов, окружённую "облаконом" свободных электронов. Эти электроны слабо связаны с отдельными атомами, и могут свободно перемещаться по всей структуре. Благодаря этому металлы обладают высокой электропроводностью и теплопроводностью.
Металлическая связь также обуславливает пластичность и деформируемость металлов, так как перемещение слабо связанных электронов позволяет ионам металла передвигаться относительно друг друга без разрушения сети. Это также критически важно для процессов сплавления и обработки металлов.
В заключение, металлическая связь является одной из основных особенностей строения атомов металла. Она обеспечивает множество уникальных свойств металлов и является основой для их использования в различных областях науки и промышленности.
Образование кристаллической решетки
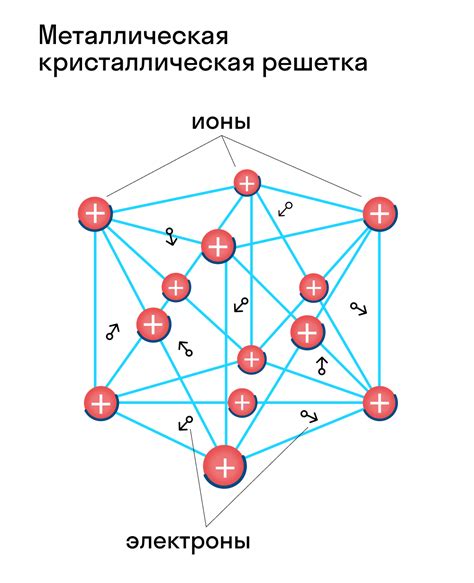
Различные металлы имеют свои особенности в строении атомов и образовании кристаллической решетки. Однако, все металлы характеризуются наличием свободно движущихся электронов.
Металлическая связь, обеспечивающая образование кристаллической решетки, основана на взаимодействии этих свободных электронов с положительно заряженными ионами металла. Это взаимодействие создает силу, которая объединяет атомы металла в кристаллическую структуру.
При образовании кристаллической решетки атомы металла располагаются в трехмерном порядке, образуя регулярные повторяющиеся структуры. Эти структуры обладают высокой степенью симметрии и могут быть представлены различными кристаллическими системами.
Важно отметить: каждый атом металла окружен сразу несколькими соседними атомами, создавая устойчивую и прочную структуру кристаллической решетки. Эта особенность позволяет металлам обладать хорошей прочностью, пластичностью и эластичностью.
Кристаллическая решетка в металлах также обладает хорошей проводимостью электричества и тепла. Свободно движущиеся электроны обеспечивают быстрое распространение электрических и тепловых сигналов через металлическую решетку.
Делокализованные электроны
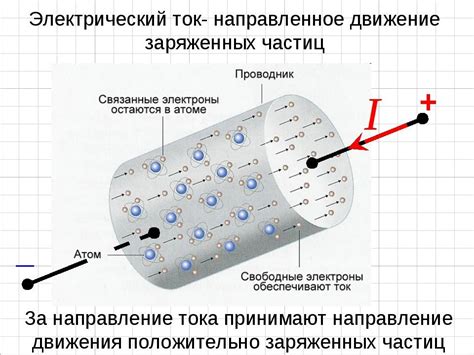
Одной из особенностей строения атомов металлов является наличие делокализованных электронов. Делокализация – это способность электронов в металле свободно перемещаться по всей его структуре, не привязываясь к конкретным атомам.
Делокализованные электроны в металлах играют ключевую роль в образовании металлической связи. Они образуют так называемое "море" электронов, которое заполняет свободные энергетические уровни и формирует отличительные свойства металлов.
Благодаря наличию делокализованных электронов, металлы обладают высокой электропроводностью и теплопроводностью. Делокализованные электроны легко перемещаются под действием внешнего электрического поля, создавая электрический ток. Также они способствуют хорошей теплопроводности металлов, так как энергия может передаваться между электронами с высокой скоростью.
Свободное перемещение делокализованных электронов также обуславливает высокую пластичность и обработку металлов. Электроны позволяют атомам металла смещаться друг относительно друга, что позволяет деформировать металлическую структуру без ее разрушения.
Важно отметить, что количество делокализованных электронов в металле зависит от его химического состава и валентности. Чем больше делокализованных электронов в металлической структуре, тем более мягким и пластичным будет металл.
Проводимость электричества и тепла

Одной из основных особенностей строения атомов металла является наличие свободных электронов, которые образуют так называемую «электронную оболочку». Эти свободные электроны могут легко перемещаться между атомами металла, что обеспечивает проводимость электричества. Таким образом, металлы являются хорошими проводниками электрического тока.
Проводимость тепла в металлах также объясняется наличием свободных электронов. Когда энергия тепла передается через металлическую структуру, свободные электроны кинетически передают эту энергию от атома к атому. Это позволяет металлам эффективно передавать и распространять тепло, делая их хорошими проводниками тепла.
Физические свойства металлов, такие как электрическая и тепловая проводимость, обусловлены структурой и свойствами их атомов. Металлы могут быть использованы для проведения электричества или передачи тепла благодаря наличию свободных электронов и специфической структуре их атомов.
Вопрос-ответ

Что такое металлическая связь?
Металлическая связь - это особенность строения атомов металла, при которой внешние электроны свободно перемещаются между атомами, образуя общий электронный газ.
Какие атомы образуют металлическую связь?
Металлическую связь образуют атомы металлов, таких как железо, медь, алюминий, свинец и др.
Как происходит образование металлической связи?
Образование металлической связи происходит при взаимодействии между атомами металла и их внешними электронами. Атомы металла отдают свои внешние электроны, которые образуют общий электронный газ и между атомами металла образуются положительно заряженные ионы.
Какие свойства обусловлены металлической связью?
Металлическая связь обусловливает ряд важных свойств металлов, таких как хорошая проводимость электричества и тепла, пластичность, металлический блеск и др.
