Атомы металла представляют собой основную структурную и функциональную единицу металлического вещества. Они имеют уникальное строение, состоящее из ядра и электронной оболочки. Ядро атома металла содержит протоны и нейтроны, образуя его массу, а электронная оболочка состоит из электронов, движущихся вокруг ядра.
Атомы металла имеют связи между собой, образуя кристаллическую решетку. Кристаллическая решетка обеспечивает металлическим веществам их характеристические механические и физические свойства, такие как проводимость тепла и электричества, пластичность и твердость.
Роль атомов металла в окислительно-восстановительных реакциях также является значительной. Атомы металла могут вступать в химические реакции с другими веществами и приобретать или отдавать электроны. Это свойство атомов металла позволяет им выполнять функцию оксиданта или восстановителя в различных химических процессах.
В окислительно-восстановительных реакциях атомы металла могут отдавать электроны и претерпевать окисление, а могут принимать электроны и восстанавливаться. Именно благодаря этому свойству металлы активно используются в различных отраслях промышленности, в том числе в электрохимии, металлургии и энергетике.
Структура атомов металла
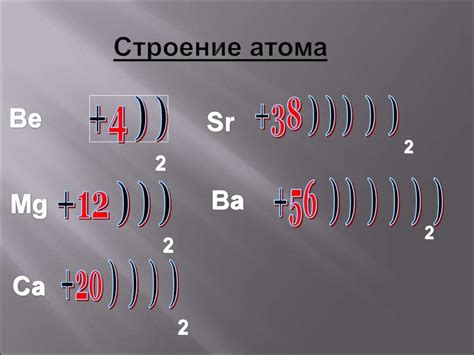
Атом металла представляет собой особую структурную единицу, состоящую из ядра и облака электронов. Ядро атома содержит протоны, несущие положительный заряд, и нейтроны, не имеющие заряда. Облако электронов, в свою очередь, состоит из электронов, обращающихся вокруг ядра.
Структура атомов металла характеризуется особенностью расположения электронов в облаке и количеством энергетических уровней. Первый энергетический уровень может вместить до 2 электронов, второй - до 8, а третий - до 18. Причем, самый внешний энергетический уровень, называемый валентным, может содержать до 8 электронов.
Валентные электроны играют важную роль в окислительно-восстановительных реакциях металлов. Они определяют степень восстановительной активности атома металла и его способность отдавать электроны другим веществам. Количество валентных электронов определяет положение металла в периодической системе элементов и его химические свойства. Чем больше валентных электронов, тем металл активнее и способнее вступать в реакции с окислителями.
Структура атомов металла также влияет на их физические свойства, такие как плавление, кристаллическую решетку, проводимость электричества и тепла. Например, металлы обладают высокой проводимостью электричества благодаря наличию свободных электронов, которые могут перемещаться в объеме металла. Кристаллическая решетка металла обеспечивает ему прочность и устойчивость к деформации.
Атомы металла и их внутреннее строение
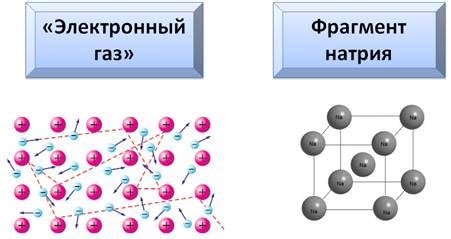
Атомы металла представляют собой основные строительные единицы металлического материала. Они обладают уникальными свойствами и внутренней структурой, которая определяет их поведение в окислительно-восстановительных реакциях.
Внешнее строение атомов металла включает ядро, состоящее из протонов и нейтронов, и облако электронов, движущихся по определенным орбитам. Протоны обладают положительным зарядом, а электроны - отрицательным зарядом. Электроны располагаются в разных энергетических уровнях и могут быть передвинуты с одного уровня на другой при воздействии внешнего воздействия.
В металлах атомы обычно образуют кристаллическую решетку, в которой каждый атом окружен несколькими соседними атомами. Это обусловлено тем, что атомы металла имеют свободные электроны, которые могут перемещаться между атомами и образовывать слабые связи между ними. Такая структура обеспечивает металлическому материалу его уникальные свойства, такие как проводимость тепла и электричества и хорошую пластичность.
Атомы металла принимают участие в окислительно-восстановительных реакциях, которые происходят при взаимодействии металла с окислителями или восстановителями. Во время окисления атомы металла теряют электроны, образуя положительно заряженные ионы, в то время как во время восстановления атомы металла получают электроны, образуя отрицательные или нейтральные ионы. Эти реакции являются основой для многих технологических процессов, таких как электролиз, гальваническая коррозия и прочие.
Роль атомов металла в окислительно-восстановительных реакциях

Атомы металла играют важную роль в окислительно-восстановительных реакциях, так как они могут легко отдавать или принимать электроны. Это связано с их особенной электронной структурой, которая включает внешний энергетический уровень с относительно свободными электронами.
При окислительно-восстановительных реакциях атомы металла могут выступать как окислители, получая электроны от других веществ, или как восстановители, отдающие свои электроны. Как окислители, они принимают электроны от веществ с более высоким потенциалом окисления, при этом сами становятся ионами с положительным зарядом. Как восстановители, атомы металла отдают свои электроны веществам с более низким потенциалом окисления, при этом сами превращаются в ионы с отрицательным зарядом.
Именно благодаря способности атомов металла легко отдавать или принимать электроны, они играют важную роль в электрохимических реакциях, таких как гальванические элементы и электролиз. В гальванических элементах атомы металла окисляются на аноде, отдавая свои электроны, которые идут по внешней цепи катоду, где происходит восстановление атомов металла. В электролизе атомы металла получают электроны на катоде и отдают их на аноде.
Также атомы металла могут участвовать в окислительно-восстановительных реакциях в растворе. Например, в растворе металлы создают ионы, которые могут подвергаться окислению или восстановлению. При окислении ионы металла получают электроны, становясь атомами с нулевым зарядом, а при восстановлении, наоборот, атомы металла отдают свои электроны и превращаются в ионы с положительным зарядом.
Таким образом, роль атомов металла в окислительно-восстановительных реакциях заключается в их способности легко отдавать или принимать электроны, что позволяет им быть активными окислителями или восстановителями в различных электрохимических процессах.
Вопрос-ответ

Каково строение атомов металла?
Строение атомов металла состоит из ядра, которое содержит протоны и нейтроны, и электронной оболочки, в которой находятся электроны.
Какую роль атомы металла играют в окислительно-восстановительных реакциях?
Атомы металла часто выступают в качестве окислителей или восстановителей в окислительно-восстановительных реакциях. Они могут отдавать или принимать электроны, что позволяет изменять их степень окисления и проводимость.
Какие элементы металла играют наиболее активную роль в окислительно-восстановительных реакциях?
Наиболее активные роли в окислительно-восстановительных реакциях играют элементы, расположенные в левой части периодической таблицы, такие как натрий, калий, железо. Они активно участвуют в электронных переносах и могут изменять свою степень окисления.
Какие изменения происходят с атомами металла в окислительно-восстановительных реакциях?
В окислительно-восстановительных реакциях атомы металла могут изменять свою степень окисления, то есть количество электронов во внешней оболочке. Они могут отдавать электроны, становясь положительно заряженными ионами (окислителями), или принимать электроны, становясь отрицательно заряженными ионами (восстановителями).
