Атом натрия - это элементарная частица, состоящая из протона в центре ядра и 11 электронов, обращающихся по орбитам вокруг него. Натрий является щелочным металлом, относящимся к первой группе периодической системы элементов.
Атом натрия имеет следующее строение: в его ядре находится 11 протонов, что определяет его атомный номер. Количество нейтронов может варьироваться, что приводит к образованию различных изотопов. Вокруг ядра электроны располагаются на нескольких энергетических уровнях, называемых электронными оболочками.
Общее количество электронов в атоме натрия равно 11, что соответствует общему числу протонов в ядре. Однако, электронная конфигурация натрия имеет особенности, связанные с заполнением электронных оболочек. На первом энергетическом уровне находится одна оболочка с единственным s-орбитальным электроном. На втором энергетическом уровне находятся две оболочки: s-орбитальная с двумя электронами и p-орбитальная с шестью электронами.
Строение атома натрия и его основные свойства определяют его химическую активность и реакционную способность. Натрий является хорошим проводником тепла и электричества, образует ионы с положительным зарядом, легко реагирует с водой и воздухом.
Общая информация о натрии

Натрий - химический элемент с атомным номером 11 и символом Na. Он относится к щелочным металлам, которые являются очень реактивными и обладают сильной щелочной реакцией.
Атом натрия имеет электронную конфигурацию 1s2 2s2 2p6 3s1, что означает наличие одного электрона в внешней энергетической оболочке. Именно этот электрон обеспечивает щелочную активность натрия.
Атомный радиус натрия составляет около 186 пикометров, а его ионный радиус в ионе Na+ составляет около 95 пикометров. Это значит, что при окислении натрия он теряет один электрон и становится положительно заряженным ионом.
Натрий имеет плотность 0,97 г/см³ и температуру плавления 97,8 градусов Цельсия. Он становится мягким и деформируемым металлом при нагревании, но при этом его плавление и испарение сопровождаются яркими пламенем и образованием оксидов.
Натрий широко используется в промышленности, особенно в процессе производства стекла и щелочей. Он также входит в состав многих солей и совокупностей, распространенных в природе и играющих важную роль в биологических процессах.
Состав атома натрия
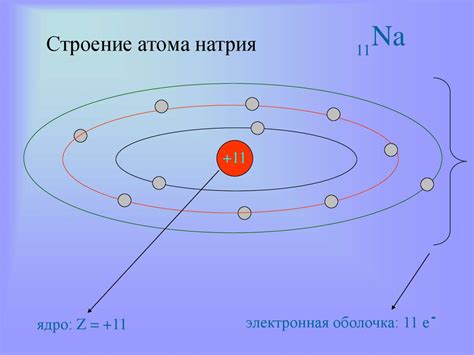
Атом натрия состоит из ядра и электронной оболочки. Ядро включает протоны и нейтроны, которые образуют основную массу атома. Протоны являются положительно заряженными частицами, а нейтроны не имеют заряда. В атоме натрия обычно находится 11 протонов, что определяет его атомный номер и позволяет относить его к химическому элементу «натрий» в периодической системе Менделеева.
Вокруг ядра атома натрия движутся электроны, которые создают электронную оболочку. Они являются отрицательно заряженными частицами и определяют химические свойства атома. Обычно в атоме натрия находится 11 электронов, что соответствует количеству протонов в ядре и обеспечивает электрическую нейтральность атома.
Как и другие щелочные металлы, атом натрия характеризуется одноэлектронной внешней оболочкой, которая обеспечивает его активность в химических реакциях. Одно внешнее элетронное окно позволяет атому натрия легко отдавать свой электрон при взаимодействии с другими элементами. Это обуславливает высокую реакционность натрия и его способность образовывать соединения с разнообразными элементами.
Электронная конфигурация атома
Электронная конфигурация атома натрия определяет расположение его электронов на энергетических уровнях и подуровнях. Атом натрия является огромным по размерам, поэтому его электронная конфигурация можно описать с помощью трех квантовых чисел: главного квантового числа, азимутального квантового числа и магнитного квантового числа.
В электронной конфигурации атома натрия главное квантовое число обозначается целым числом n и определяет энергетический уровень, на котором находится электрон. Для атома натрия главное квантовое число равно 3, что означает, что электроны находятся на третьем энергетическом уровне.
Азимутальное квантовое число обозначается буквами s, p, d, f и определяет подуровень энергетического уровня, на котором находится электрон. Для атома натрия азимутальное квантовое число равно p, что означает наличие электрона на p-подуровне третьего энергетического уровня.
Магнитное квантовое число обозначается целым или полуцелым числом m и определяет ориентацию орбитали электрона в пространстве относительно магнитного поля. Для атома натрия магнитное квантовое число может быть равно -1, 0 или 1, что означает наличие трех возможных ориентаций орбитали на p-подуровне.
Таким образом, электронная конфигурация атома натрия будет такой: 1s^2 2s^2 2p^6 3s^1, где верхние индексы обозначают количество электронов на соответствующем энергетическом уровне и подуровне. Атом натрия имеет общую электронную конфигурацию 2-8-1, что говорит о наличии 11 электронов.
Химические свойства натрия

Натрий - это химический элемент с атомным номером 11 и символом Na в периодической системе элементов. У натрия есть несколько основных химических свойств, которые определяют его реактивность и использование в различных процессах.
1. Активность: Натрий является очень активным металлом и легко реагирует с кислородом воздуха. Поэтому натрий хранится в защитной среде, чтобы избежать окисления. Он может также реагировать с водой, выделяя водородный газ.
2. Щелочные свойства: Натрий относится к группе щелочных металлов и обладает характерными щелочными свойствами. Он растворяется в воде, образуя гидроксид натрия (щелочь).
3. Реакция с кислотами: Натрий реагирует с различными кислотами, образуя соль и выделяя водородный газ. Эта реакция является характерной для щелочных металлов.
4. Реакция с галогенами: Натрий реагирует с галогенами (хлор, бром, йод) и образует соответствующие соли. Реакция с хлором является особенно интенсивной.
5. Реакция с аммиаком: Натрий реагирует с аммиаком и образует соль аммония и водород.
Эти свойства натрия делают его важным элементом в промышленности и химических процессах. Он используется в производстве стекла, мыла, щелочных батарей и других продуктов.
Физические свойства натрия

Натрий (Na) - активный щелочной металл, обладающий рядом характерных физических свойств.
Металлический блеск: Натрий обладает ярким металлическим блеском на поверхности, что делает его привлекательным для использования в декоративных целях.
Мягкость: Натрий является мягким металлом, который может быть резан ножом или нарезан на ленты. Эта мягкость делает его хорошим материалом для производства некоторых электронных компонентов и солнечных батарей.
Пластичность: Натрий обладает хорошей пластичностью, что позволяет его легко деформировать и применять для создания различных форм и фигур.
Низкая плотность: Натрий имеет низкую плотность, что делает его легким и удобным для использования в различных промышленных и технических процессах.
Низкая плавкость: Натрий имеет низкую точку плавления, что делает его легким для плавления и применения в различных производственных процессах.
Высокая теплопроводность: Натрий обладает высокой теплопроводностью, что делает его полезным материалом в производстве нагревательных элементов и электрических проводов.
Кроме того, натрий обладает хорошей электропроводностью, низкой твердостью и высокой реактивностью. Эти особенности делают его важным элементом в различных промышленных, технических и химических процессах.
Использование натрия в промышленности

Натрий является одним из самых важных металлов в промышленности и широко используется в различных областях.
Одним из основных способов использования натрия является его применение в производстве щелочей, таких как гидроксид натрия (NaOH) и карбонат натрия (Na2CO3). Щелочи находят применение в производстве стекла, мыла, моющих средств, бумаги, текстиля и других товаров повседневного спроса.
Натрий также используется в металлургической промышленности. Он добавляется в сплавы для улучшения их химических и физических свойств. Натрий может быть также использован для изготовления специальных сплавов с алюминием и другими металлами.
Одним из самых известных продуктов из натрия является кристаллическая соль, которая широко используется в пищевой промышленности и в быту. Натрий также играет важную роль в производстве галогенидов, кислот и других химических соединений.
Кроме того, натрий является неотъемлемой частью процессов электролиза и аккумуляторных технологий. Он широко используется в производстве алкалиевых и щелочных элементов, которые находят применение в энергетике и электронике.
Таким образом, использование натрия в промышленности является неотъемлемым элементом многих процессов и отраслей, обеспечивая производство широкого спектра продуктов и материалов.
Опасность и меры предосторожности при работе с натрием
Натрий - это один из основных элементов в группе щелочных металлов, и его использование может быть связано с опасностями. При работе с натрием необходимо принимать определенные меры предосторожности, чтобы предотвратить возможные аварийные ситуации и минимизировать риск для здоровья.
Во-первых, натрий реагирует с водой, образуя очень реактивный и взрывоопасный газ – водород. При попадании натрия в воду может произойти резкая реакция, которая сопровождается выделением водорода и большим количеством тепла. Поэтому важно работать с натрием только в хорошо проветриваемых помещениях или под вытяжной вентиляцией.
Во-вторых, натрий является пожароопасным материалом. Он может загораться при контакте с кислородом или воздухом, особенно в порошкообразном состоянии. Поэтому необходимо избегать попадания натрия в пространство с большим содержанием кислорода и продолжительное время хранить его в герметично закрытых контейнерах.
При работе с натрием нужно надевать защитные очки, резиновые перчатки и одежду, закрывающую все тело. Это позволит избежать контакта натрия с кожей и глазами. В случае попадания натрия на кожу или в глаза необходимо незамедлительно промыть пораженные участки большим количеством воды и обратиться к медицинскому персоналу.
Также стоит учитывать, что натрий может образовывать взрывоопасные смеси с некоторыми органическими веществами. Поэтому необходимо избегать контакта натрия с органическими растворителями и другими легковоспламеняющимися материалами.
В общем, при работе с натрием необходимо быть очень осторожным и соблюдать все необходимые меры предосторожности. Знание и понимание опасности, а также соблюдение правил безопасности помогут избежать неприятных ситуаций и обеспечить безопасность работников и окружающих.
Вопрос-ответ

Какова электронная конфигурация атома натрия?
Электронная конфигурация атома натрия: 1s2 2s2 2p6 3s1. Это означает, что у атома натрия есть 11 электронов, распределенных по различным энергетическим уровням и подуровням.
Чем характеризуется строение атома натрия?
Строение атома натрия характеризуется наличием ядра, в котором находятся протоны и нейтроны, а также облака электронов, расположенного вокруг ядра по энергетическим уровням и подуровням. Атом натрия имеет один электрон на внешнем энергетическом уровне, что делает его реактивным.
Какие основные свойства имеет металл натрий?
Металл натрий относится к щелочным металлам и имеет следующие основные свойства: низкую плотность, мягкость, хорошую электропроводность, низкую температуру плавления и кипения, активность при химических реакциях, а также способность образовывать ионы с положительным зарядом.
Почему металл натрий реактивен?
Металл натрий является реактивным из-за наличия одного электрона на внешнем энергетическом уровне. Такой атом стремится избавиться от этого электрона и при реакции с другими веществами образует ион натрия с положительным зарядом.
Какие соединения может образовать натрий?
Натрий может образовывать соединения с различными веществами, включая воду, кислород, серу, азот и многими другими элементами. Некоторые известные соединения натрия включают натриевую соль (NaCl), натриевый гидроксид (NaOH) и натриевый карбонат (Na2CO3).
