Атом металла - основная единица химической структуры металлического элемента. Каждый металл представлен в таблице Менделеева своим атомным номером, атомной массой и химическим символом. Атомы металлов обладают особыми свойствами, такими как высокая проводимость электричества и тепла, способность формировать кристаллические решетки и многие другие. Однако, структура атома металла несколько отличается от структуры других элементов.
Внутри атома металла находятся электроны, протоны и нейтроны. Протоны и нейтроны, объединенные в ядро, образуют его массу, а электроны находятся вокруг ядра на энергетических уровнях. Однако, помимо основных энергетических уровней, атомы металлов имеют особенность - уровень проводимости, который может быть заполнен или иметь свободные электроны. Именно наличие свободных электронов и обсадка их оболочкой ядра делает металлы хорошими проводниками электрического тока.
Кроме того, атомы металлов могут образовывать кристаллическую решетку, то есть атомы металлов упорядочены по определенной схеме, которая повторяется во всем металле. Это объясняет многие физические свойства металлов, такие как тугоплавкость и высокая прочность. Структура атома металла по таблице Менделеева имеет свои особенности, которые делают металлы столь важными и универсальными материалами в различных областях нашей жизни.
Металлы в таблице Менделеева
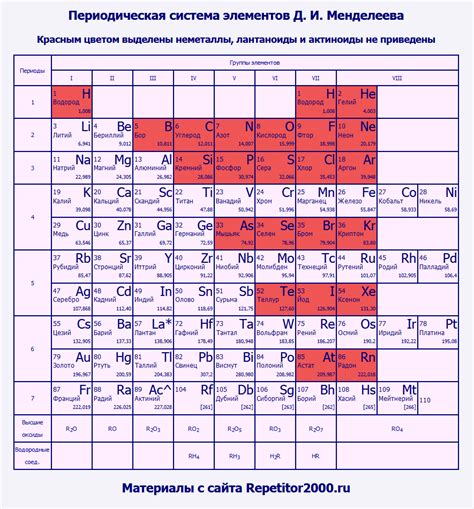
Таблица Менделеева является основой современной химии и представляет собой систематическое упорядочение элементов по возрастанию атомных номеров. Она позволяет легко определить химические свойства и структуру атома каждого элемента. Металлы составляют значительную часть таблицы Менделеева и имеют ряд общих характеристик.
В большинстве случаев, металлы включают элементы, находящиеся слева от таблицы Менделеева. Они обладают характерными свойствами, такими как хорошая теплопроводность, электропроводность и гибкость. Металлы обычно образуют ионы положительного заряда, отдавая один или несколько электронов. Они также являются хорошими проводниками электричества и тепла, что делает их необходимыми материалами во многих областях, включая электронику, строительство и промышленность.
Металлы могут быть разделены на две группы: благородные и неблагородные. Благородные металлы обладают высокой устойчивостью к окислению и имеют низкий уровень реактивности. Их атомы обычно имеют полную электронную оболочку и малую электроотрицательность. Примерами благородных металлов являются золото, платина и серебро.
Неблагородные металлы менее устойчивы к окислению и более реактивны. Их атомы имеют частично заполненные электронные оболочки и более высокую электроотрицательность. Многие из неблагородных металлов являются реагентами или катализаторами в химических реакциях. Примерами неблагородных металлов являются железо, алюминий и медь.
Все металлы в таблице Менделеева имеют свои уникальные свойства и важные приложения в различных областях науки и промышленности. Изучение их структуры и химических свойств позволяет более глубоко понять их роль в окружающем мире и развивать новые материалы и технологии.
Определение металлов и их свойства
Металлы - это класс химических элементов, обладающих рядом характерных свойств. Главной особенностью металлов является их способность проводить тепло и электричество. Большинство элементов в периодической таблице Менделеева относятся к металлам.
Свойства металлов объясняются их кристаллической структурой и особенностями электронной оболочки. У металлов обычно большое количество свободных электронов, которые ответственны за их электропроводность.
Основные свойства металлов:
- Высокая теплопроводность и электропроводность. Металлы являются отличными проводниками тепла и электричества. Это делает их незаменимыми материалами в электротехнике и промышленности.
- Пластичность и формоизменяемость. Металлы обладают способностью быть легко деформируемыми и изменять свою форму без разрушения. Это позволяет использовать их для изготовления различных изделий.
- Химическая активность. Некоторые металлы могут реагировать с другими веществами, образуя соединения. Это позволяет использовать их в различных химических процессах.
- Блеск и отражательность. Металлы обладают характерным блеском и отражают свет. Именно благодаря этим свойствам они используются для создания различных декоративных предметов и зеркал.
- Высокая плотность. Металлы обычно имеют высокую плотность, что делает их тяжелыми и прочными материалами.
Металлы играют важную роль в нашей повседневной жизни. Они используются в строительстве, производстве машин и оборудования, электронике, автомобилестроении и многих других отраслях промышленности. Благодаря своим уникальным свойствам, металлы являются неотъемлемой частью современного мира.
Строение атома металла
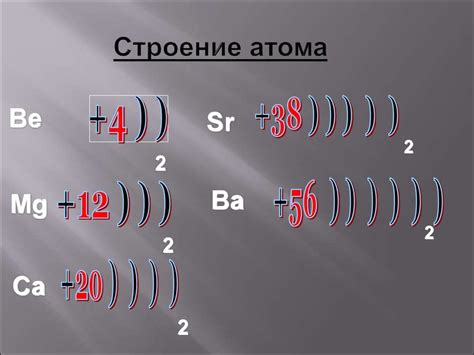
Атом металла представляет собой особую структуру, обладающую определенными характеристиками. Каждый атом металла состоит из ядра, в котором находятся протоны и нейтроны, и электронной оболочки, в которой находятся электроны. Ядро является положительно заряженным и содержит большую часть массы атома, в то время как электронная оболочка представляет собой облако электронов, окружающих ядро.
При анализе таблицы Менделеева, можно заметить, что строение атома металла определяется его местом в периодической системе химических элементов. Металлы находятся в левой части таблицы, что указывает на наличие в их атомах одного или нескольких свободных электронов в валентной оболочке. Это делает металлы хорошими проводниками электричества и тепла.
Строение атома металла придает ему специфические свойства. Например, металлы обладают высокой термической и электрической проводимостью, что связано с наличием свободных электронов. Кроме того, у атомов металлов может быть различное количество энергетических уровней и подуровней, что влияет на их химическую активность и способность образовывать соединения с другими элементами.
Важным свойством атома металла является его способность к образованию металлической связи. В металлической связи электроны образуют своеобразное облако, свободно перемещающееся между атомами. Это облегчает проводимость электричества и способствует высокой пластичности и термопроводности металлов.
Электронная оболочка атома металла
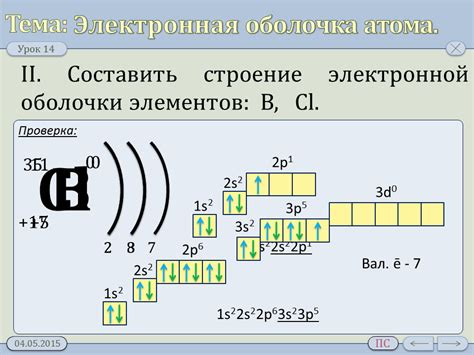
Атомы металлов обладают своеобразной структурой электронной оболочки, которая отличает их от других элементов. Основными особенностями электронной оболочки металлов являются наличие одного или нескольких свободных электронов и способность образовывать межатомные связи.
Свободные электроны в атомах металлов играют важную роль в их физических и химических свойствах. Благодаря свободным электронам металлы обладают высокой проводимостью электричества и тепла. Они могут передвигаться между атомами и образовывать электронный газ, что придает металлам их металлический блеск и характерный вид.
Однако межатомные связи в металлах не так прочны, как в других элементах. Это связано с деликатным балансом между притяжением положительно заряженных ядер атомов и отталкиванием свободных электронов. Такая структура электронной оболочки металлов позволяет им легко изменять свою форму и обладать высокой пластичностью.
Помимо свободных электронов, электронная оболочка атома металла может содержать также валентные электроны. Валентные электроны находятся на самом внешнем энергетическом уровне и играют важную роль в химических реакциях металлов. Они могут участвовать в образовании химических связей с другими атомами и образовывать различные соединения.
Таким образом, электронная оболочка атома металла является основным фактором, определяющим его химические и физические свойства. Именно наличие свободных электронов и возможность образования межатомных связей делает металлы одними из самых полезных и широко используемых материалов в нашей повседневной жизни.
Ионизационная энергия металлов
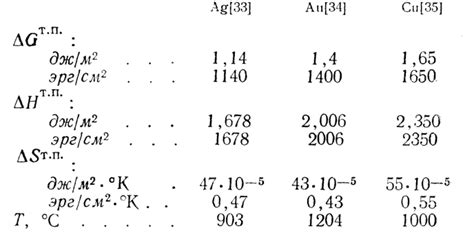
Ионизационная энергия металлов является важной характеристикой атома металла и определяет энергию, необходимую для удаления одного электрона из атома. Чем выше значение ионизационной энергии, тем тяжелее отделить электрон от атома металла.
У металлов, обладающих низкой ионизационной энергией, электроны слабо связаны с атомом и имеют большую подвижность, что делает их проводниками электричества и тепла. Это основа для металлического свойства металлов.
В таблице Менделеева металлы расположены в левой части, где они имеют низкое значение ионизационной энергии. Для металлов характерно положительное значение ионизационной энергии, что означает, что энергия будет потрачена на удаление электрона.
Ионизационная энергия металлов зависит от многих факторов, включая количество электронов в атоме, радиус атома и заряд ядра. Чем больше протонов в атоме, чем меньше радиус, тем выше значение ионизационной энергии. Это связано с тем, что с увеличением заряда ядра слабее освобождаются электроны из атома.
Сравнение значений ионизационной энергии металлов позволяет классифицировать их по относительной тяжести отделения электронов. Наиболее тяжелые металлы обладают высокой ионизационной энергией, что делает их менее реактивными и труднодоступными для электронных реакций.
- Металлы с низкой ионизационной энергией (например, литий, натрий, калий) широко используются в производстве батарей и аккумуляторов.
- Металлы с высокой ионизационной энергией (например, платина, золото, серебро) ценятся за свою устойчивость к химическим реакциям и используются в ювелирной промышленности.
Знание ионизационной энергии металлов позволяет предсказывать и объяснять их химическое и физическое поведение. Важно учитывать этот параметр при выборе материала для конкретных технических и промышленных задач.
Применение металлов

Металлы широко применяются в различных отраслях промышленности и научных исследованиях благодаря своим уникальным свойствам. Например, алюминий, благодаря своей низкой плотности и хорошей термической и электропроводности, находит применение в авиационной и автомобильной промышленности, а также в производстве упаковочных материалов и напитков. Никель используется в производстве стали и предметов бытового назначения, таких как монеты и посуда.
Железо является одним из самых распространенных металлов и находит широкое применение в строительстве, машиностроении и производстве различных товаров для ежедневного использования. Оно обладает высокой прочностью и хорошей деформационной способностью, что позволяет его использовать для изготовления различных конструкций и деталей.
Золото и серебро, благодаря своей высокой электропроводности и хорошей коррозионной стойкости, в основном используются в ювелирной и электронной промышленности. Эти металлы также находят применение в производстве монет, медалей и других изделий.
Медь, благодаря своим электропроводным и теплопроводным свойствам, используется в электротехнике, строительстве и производстве труб и кабелей. Она имеет высокую коррозионную стойкость, что делает ее особенно полезной в морском и судостроительном оборудовании.
Также стоит отметить применение других металлов, таких как свинец, цинк, алюминий, магний, которые используются в производстве аккумуляторов, конструкций, автомобильных деталей, литейных форм и других изделий. Каждый металл имеет свои уникальные свойства, которые делают его незаменимым в определенных областях.
Вопрос-ответ

Какая структура атома металла по таблице Менделеева?
Структура атома металла состоит из ядра, которое содержит протоны и нейтроны, и электронов, которые обращаются по орбитам вокруг ядра.
Какие элементы находятся в группе металлов по таблице Менделеева?
В группу металлов по таблице Менделеева входят такие элементы, как натрий, калий, железо, медь, серебро и т.д. Всего в таблице Менделеева 18 групп металлов.
