Атом металла является основным строительным блоком металлических материалов. Он обладает рядом характеристик и свойств, которые определяют их уникальный набор физических и химических свойств.
В основе атома металла лежит ядро, состоящее из протонов и нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Вокруг ядра находятся электроны, которые обладают отрицательным зарядом. Электроны движутся по определенным энергетическим уровням, находящимся на различных орбиталях.
Основной характеристикой атома металла является его атомный номер, который определяет количество протонов в его ядре. Он также определяет положение металла в периодической системе химических элементов. Количество электронов в атоме металла соответствует количеству протонов и является основным фактором, определяющим его химическую активность и способность образовывать связи с другими атомами.
Кроме того, атомы металла характеризуются своей электронной конфигурацией, которая определяет их энергетический уровень и способность проводить электричество и тепло. Металлы обладают высокой электропроводностью и теплопроводностью благодаря свободным электронам, которые легко передвигаются по кристаллической решетке.
Структура атома металла также определяет его механические свойства, такие как пластичность, прочность и упругость. Металлы обладают высокой пластичностью, что означает их способность деформироваться без разрушения. Их прочность зависит от кристаллической структуры и способности электронов передавать напряжение через материал.
Изучение строения атома металла и его свойств является важной областью науки и техники, которая позволяет понять и оптимизировать свойства металлических материалов для различных применений. Это также позволяет разрабатывать новые металлические сплавы с улучшенными свойствами и находить новые области их применения.
Строение атома металла
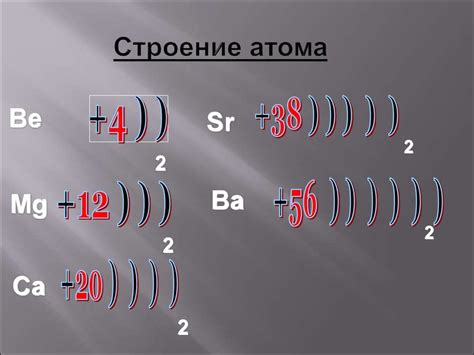
Металлы являются основными элементами периодической системы, и их атомы имеют определенное строение. Атом металла состоит из ядра и электронной оболочки. Ядро, как правило, содержит протоны и нейтроны, а внешние электроны образуют оболочку.
Ядро атома металла - это его центральная часть, которая содержит протоны и нейтроны. Протоны имеют положительный заряд, тогда как нейтроны не имеют заряда. Общее число протонов в ядре определяет атомный номер металла и его положение в периодической системе элементов.
Вокруг ядра находится электронная оболочка, которая содержит электроны. Электроны имеют отрицательный заряд и обращаются по определенным орбитам вокруг ядра. Количество электронов в оболочке определяет электронную конфигурацию атома. Обычно энергетически более низкие уровни оболочки заполняются сначала, а затем более высокие.
Строение атома металла влияет на его свойства. Например, протоны и нейтроны в ядре определяют массу атома, а количество электронов в оболочке влияет на его химическую активность. В результате, атомы металлов обладают характерными свойствами, такими как теплопроводность, электропроводность и пластичность, которые делают их ценными материалами в различных отраслях промышленности.
Атомы металла: основные характеристики

Металлы являются основными строительными блоками материи. В структуре металла атомы играют принципиальную роль. Атомы металла обладают рядом характеристик, которые определяют их уникальные свойства.
Атомы металла обладают большими размерами и массой. Они имеют кристаллическую решетку, что означает, что атомы упорядочены в пространстве и образуют кристаллическую структуру. Внутри решетки атомы металла связаны между собой металлической связью, которая характеризуется свободным движением электронов.
Атомы металла имеют относительно невысокую электроотрицательность, что позволяет им легко отдавать и принимать электроны. Как результат, металлы обладают высокой электропроводностью и теплопроводностью. Атомы металла также обладают свойством деформироваться пластично, что позволяет металлам быть гибкими и прочными материалами.
У атомов металла есть внешняя оболочка электронов, называемая валентной оболочкой. Валентные электроны могут участвовать в химических реакциях и образовывать химические связи с другими атомами. Благодаря этому, металлы могут создавать разнообразные соединения и сплавы, что делает их неотъемлемой частью современных технологий и промышленности.
Электронная оболочка атома металла
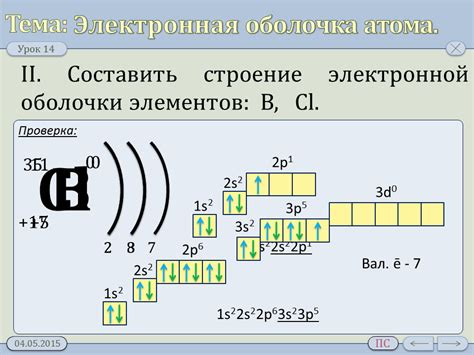
Электронная оболочка атома металла состоит из электронов, которые движутся вокруг ядра на энергетических уровнях. Основные энергетические уровни образуют оболочки, которые обозначаются буквами K, L, M и так далее. Каждая оболочка может содержать определенное количество электронов, которое зависит от их энергетического состояния.
Наиболее внешняя оболочка атома, называемая валентной оболочкой, играет важную роль в химических реакциях и свойствах металла. Валентная оболочка содержит валентные электроны, которые могут участвовать в обмене электронами с другими атомами, образуя химические связи.
Металлы обладают особенностью валентной оболочки, а именно наличием нескольких электронов в этой области. У них также проявляется способность отдавать эти электроны и образовывать положительно заряженные ионы. В результате этой способности металлы обладают высокой электропроводностью и хорошей теплопроводностью.
Валентные электроны атома металла также определяют его химическую активность и способность вступать в химические реакции. Металлы образуют положительно заряженные ионы, когда отдают один или несколько электронов, и могут образовать положительные ионы с разной степенью заряда в зависимости от количества отданных электронов.
Ядро атома металла: состав и свойства
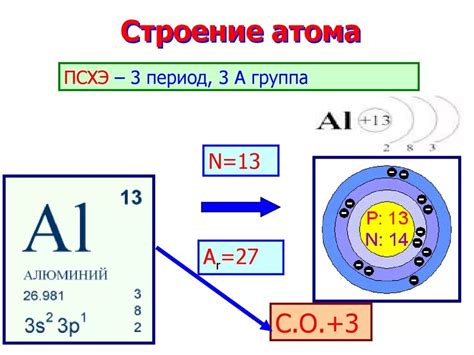
Ядро атома металла - это его центральная часть, состоящая из протонов и нейтронов. Протоны являются элементарными частицами с положительным электрическим зарядом, а нейтроны не имеют заряда. Совокупность протонов и нейтронов образует ядро атома, которое содержит большую часть его массы.
Протоны и нейтроны имеют практически одинаковую массу, которая составляет примерно 1.67 × 10^-27 килограмма. Они содержатся в ядре атома плотно упакованными. Протоны обладают положительным электрическим зарядом, равным элементарному заряду, такому же, как у электрона, но противоположного знака. Нейтроны, как следует из названия, не имеют электрического заряда, они являются электрически нейтральными частицами.
Ядро атома металла обладает несколькими важными свойствами. Во-первых, оно обеспечивает стабильность атома, предотвращая его разрушение. Во-вторых, ядро определяет массу атома, так как в нем содержится большая часть его массы. Кроме того, ядро влияет на химические свойства металла, так как количество протонов в ядре определяет его атомный номер и позицию в периодической таблице элементов.
Изотопы атомов металла
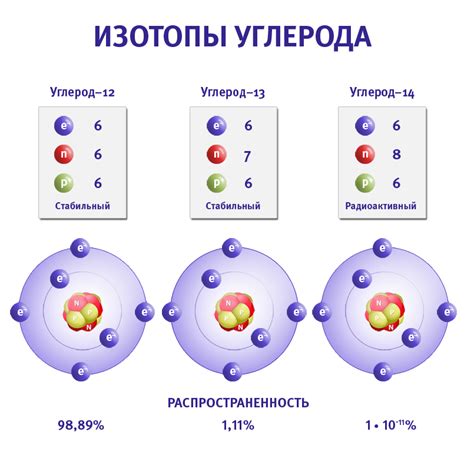
Изотопы – это атомы одного и того же элемента, у которых количество нейтронов в ядре отличается. В атомах металлов также могут существовать изотопы, которые имеют разное количество нейтронов, но одинаковое количество протонов в ядре.
Изотопы металлов имеют примерно одинаковые химические свойства, так как основные характеристики атома определяются количеством протонов и электронов. Однако, различное количество нейтронов в изотопах может влиять на их физические свойства, например, на массу или стабильность атома.
В таблице ниже приведены некоторые изотопы металлов и их основные характеристики:
| Металл | Изотоп | Процент содержания в природе | Массовое число | Период полураспада |
|---|---|---|---|---|
| Железо | Fe-56 | 91.75% | 56 | не распадается |
| Уран | U-238 | 99.27% | 238 | 4.5 млрд лет |
| Свинец | Pb-206 | 24.1% | 206 | не распадается |
Процент содержания в природе показывает относительную частоту встречаемости данного изотопа в природе относительно других изотопов того же элемента. Массовое число – это сумма протонов и нейтронов в ядре атома. Период полураспада характеризует время, за которое половина исходного количество изотопа превратится в другой элемент.
Изучение изотопов металлов позволяет углубить наши знания о строении атомов и свойствах металлов, а также применить их в различных областях, таких как атомная энергетика или анализ состава материалов.
Физические и химические свойства атомов металла

Атомы металла обладают рядом уникальных физических и химических свойств, которые определяют их особую роль в различных процессах и явлениях.
Одной из основных характеристик атомов металла является их структура. Внутри атома металла находится ядро, состоящее из протонов и нейтронов, а вокруг ядра располагаются электроны. Эта сложная структура обуславливает некоторые характеристики атомов металла.
Первое физическое свойство атомов металла - их проводимость электричества и тепла. Это связано с наличием свободных электронов в валентной оболочке атомов металла, которые могут свободно двигаться под действием электрического поля. Также свободные электроны способны эффективно переносить тепло эффектом электронного теплопроводности.
Другое химическое свойство атомов металла - их способность образовывать ионные связи. Атомы металла могут отдавать электроны и образовывать положительные ионы (катионы). Это свойство обуславливает возможность образования металлических соединений и способность металлов к термическим и химическим реакциям.
Кроме того, металлы обладают высокой плотностью и температурой плавления. Это объясняется силами взаимодействия атомов металла внутри его гидратной структуры. Именно благодаря этой особенности металлы обладают прочностью и устойчивостью к механическим нагрузкам.
Таким образом, физические и химические свойства атомов металла определяют их специфическую роль в различных областях нашей жизни - от электроники и силовой индустрии до металлургического производства и синтеза новых материалов.
Вопрос-ответ

Какие основные характеристики строения атома металла?
Атом металла состоит из электронной оболочки и ядра. Ядро состоит из протонов и нейтронов, а электронная оболочка содержит электроны, которые движутся по орбитам вокруг ядра.
Чем отличается атом металла от атома неметалла?
Атом металла отличается от атома неметалла тем, что у металла оболочка электронов в основном заполнена для достижения стабильности, в то время как у неметаллов оболочка электронов часто не полностью заполнена.
Какие свойства имеют атомы металла?
Атомы металлов обладают такими свойствами, как высокая электропроводность, пластичность, твердость и высокая температура плавления. Эти свойства обусловлены специфическим строением и связью атомов в металлической решетке.
Какое влияние на свойства металлов оказывает строение их атомов?
Строение атомов металлов, а именно наличие свободных электронов, является одной из причин высокой электропроводности и теплопроводности металлов. Кроме того, строение атомов влияет на способность металлов образовывать межатомные связи и формировать металлическую решетку, что придает им определенные механические и химические свойства.
Какие еще особенности имеют атомы металла?
У атомов металла есть уровень ферми, который играет важную роль в электронной структуре и свойствах металлических материалов. Кроме того, атомы металлов имеют высокую плотность электронов в электронной оболочке, что влияет на их взаимодействие с другими атомами и свойства металлов в целом.
