Алюминий – это металл из группы элементов периодической системы, химический символ которого Al. В периодической системе Менделеева он находится в третьей группе, а его атомный номер 13. Интересно, что атом алюминия обладает уникальными свойствами и структурой, которые его выделяют среди других элементов.
Атом алюминия состоит из ядра и электронной оболочки. Ядро атома состоит из протонов (частиц с положительным зарядом) и нейтронов (частиц без заряда). Протоны и нейтроны находятся в центре атома, в небольшом пространстве, называемом ядром. Количество протонов определяет атомный номер элемента и его положение в периодической системе.
Вокруг ядра располагается электронная оболочка, которая включает в себя электроны - частицы с отрицательным зарядом. Количество электронов в атоме определяет его электронную конфигурацию и его химические свойства. У атома алюминия есть 13 электронов, которые распределены по различным энергетическим уровням и орбиталям. Электроны расположены на определенных орбиталях вокруг ядра и между ними могут существовать только определенные количество электронов.
Строение атома металла алюминия
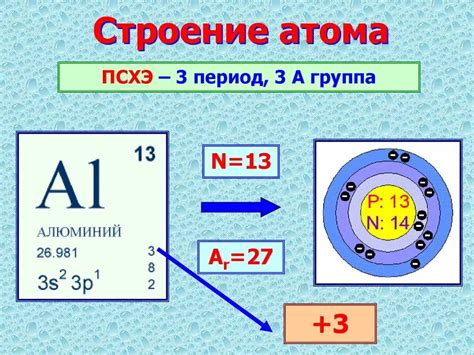
Аллюминий (Al) - это химический элемент с атомным номером 13 и средней атомной массой 26.98 г/моль. Он является третьим по распространенности элементом в земной коре.
Атом алюминия состоит из ядра, окруженного электронной оболочкой. Ядро атома содержит 13 протонов и обычно 14 нейтронов. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Общий заряд положительный и равен числу протонов.
Электронная оболочка атома состоит из 13 электронов, которые обращаются вокруг ядра по определенным орбитам. Каждая орбита способна вместить определенное количество электронов. Орбитальная модель атома алюминия включает 2 электрона на первой оболочке, 8 электронов на второй оболочке и 3 электрона на третьей оболочке.
Структура атома алюминия обуславливает его физические и химические свойства. Наличие трех электронов на третьей оболочке делает алюминий активным металлом. Он легко взаимодействует с другими элементами и образует соединения.
Основные характеристики

Металл алюминий является тринадцатым по порядку элементом периодической таблицы химических элементов и обладает атомным номером 13. Его символом в таблице является Al. Алюминий принадлежит к группе легких металлов и относится к щелочноземельным металлам.
Атом алюминия имеет структуру, состоящую из 13 электронов и 13 протонов. Внутри ядра атома расположены 13 протонов и, соответственно, 13 электронов образуют облако вокруг ядра. Атомная масса алюминия составляет примерно 27 единиц.
Структура атома алюминия характеризуется наличием трех электронных оболочек. На первой оболочке расположен 2 электрона, на второй – 8 электронов, а на третьей – 3 электрона. Отчетливо видно, что на третьей оболочке находятся 3 электрона, что соответствует порядковому номеру атома алюминия.
Такая структура атома обуславливает химические свойства алюминия. Наличие 3 электронов на последней оболочке делает алюминий металлом средней активности. Структура атома алюминия также влияет на его характеристики, такие как пластичность, теплопроводность и электропроводность. Благодаря высокой пластичности, алюминий легко обрабатывается и используется в различных отраслях промышленности.
Структура атома
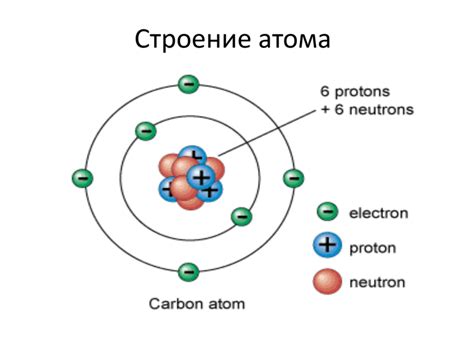
Атом алюминия - это основная единица структуры данного элемента. Он состоит из протонов, нейтронов и электронов, которые находятся в двух основных областях - ядре и облаке электронов.
Ядро атома алюминия содержит протоны и нейтроны. Протоны имеют положительный заряд, а нейтроны не имеют заряда. Число протонов в ядре называется атомным номером и определяет химические свойства элемента. В случае алюминия атомный номер равен 13.
Электроны - это отрицательно заряженные частицы, которые обращаются по орбитам вокруг ядра. Количество электронов в атмоае алюминия также равно 13, что обусловлено электронной конфигурацией и следующим принципом: первая оболочка (K) может вмещать не более 2 электронов, вторая оболочка (L) - не более 8 электронов, а третья оболочка (M) - не более 8 электронов.
Обмен электронами между атомами позволяет создавать связи, что определяет структуру и свойства вещества. Важно отметить, что атом алюминия в свободном состоянии старается обрести положительный заряд путем потери трех электронов. Это делает его атичным радикалом, что способствует его химической активности и использованию в различных промышленных и научных областях.
Физические и химические свойства
Алюминий является лёгким и довольно прочным металлом с серебристым блеском. Он обладает хорошей кондуктивностью тепла и электричества, что делает его востребованным материалом в различных отраслях промышленности. Точка плавления алюминия составляет около 660 градусов Цельсия, а его плотность примерно равна 2,7 г/см3.
Алюминий обладает высокой степенью реакционности, образуя оксидную плёнку на поверхности при контакте с воздухом. Эта плёнка обеспечивает защиту металла от окисления и коррозии. Причиной такой стабильности является пассивация алюминия – способность образовывать защитные оксидные слои.
Алюминий легко реагирует с кислотами, особенно с сильными кислотами, такими как соляная кислота. При таких реакциях выделяется водород. Однако, алюминий не реагирует с щелочами.
Благодаря своим химическим свойствам, алюминий находит широкое применение в различных отраслях промышленности, а также в строительстве и пищевой промышленности.
Применение атома металла алюминия
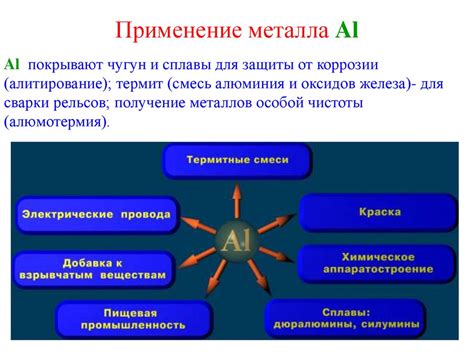
Атом металла алюминия широко используется в различных областях промышленности и научных исследований. Его уникальные свойства делают его незаменимым во многих процессах и производствах.
Одним из основных применений атома алюминия является его использование в производстве металлургической и легкой промышленности. Алюминий используется для создания различных сплавов, таких как алюминиевые сплавы с медью или магнием, которые обладают высокой прочностью и легкостью. Эти сплавы применяются в авиационной и автомобильной промышленности, а также в строительстве.
Атом алюминия также находит применение в производстве упаковочных материалов. Благодаря своей легкости и стойкости к коррозии, алюминиевые фольга и контейнеры широко используются для упаковки пищевых продуктов, лекарственных препаратов и других товаров.
Кроме того, атом алюминия находит применение в производстве электроники. Алюминиевые компоненты и провода используются в различных электронных устройствах, включая компьютеры, смартфоны и телевизоры. Алюминий также используется в производстве кабелей и алюминиевой фольги, которые широко применяются в электротехнике и электроэнергетике.
Вопрос-ответ

Каково строение атома металла алюминия?
Атом металла алюминия имеет строение, принадлежащее к кристаллической решетке. Он состоит из ядра, в котором находится протон и нейтрон, и облака электронов, вращающихся вокруг ядра по орбитам.
Чему равно количество электронов в атоме алюминия?
Количество электронов в атоме алюминия равно 13.
Как выглядит кристаллическая решетка атомов алюминия?
Кристаллическая решетка атомов алюминия имеет гранулированную структуру. Каждый атом алюминия имеет шестигранные плоскости, которые образуют трехмерную сетку.
Какие свойства имеет атом алюминия?
Атом алюминия отличается высокой химической активностью. Он обладает электроотрицательностью, малой электронной отталкивающей силой, а также формирует положительные ионы в химических реакциях.
Какие параметры определяют структуру атома алюминия?
Структура атома алюминия определяется его массовым числом, атомным радиусом, радиусом Куллона и электронной конфигурацией.
