Атом является основным строительным элементом материи. Его строение состоит из ядра, которое содержит протоны и нейтроны, и облака электронов, обращающихся вокруг ядра. Строение атома определяет его химические и физические свойства.
Цезий – это элемент, который относится к группе щелочных металлов в таблице Менделеева. Внешний электронный слой цезия содержит всего один электрон, что делает его очень реактивным металлом. Цезий имеет атомный номер 55 и массовое число 133.
Цезий обладает несколькими характерными свойствами металлов. Он является хорошим проводником электричества и тепла, обладает металлическим блеском и имеет высокую плотность. В то же время, цезий очень мягкий и может быть нарезан ножом.
Свойства цезия связаны с его строением атома. Большой размер атома и слабое взаимодействие между электронами внешнего слоя делает его электроотрицательность низкой, что позволяет легко отдавать электроны другим элементам. Это является причиной высокой реактивности цезия и способности образовывать соединения с другими элементами.
Таким образом, строение атома цезия и характерные для металлов свойства делают его типичным представителем металлов. Его использование широко распространено в различных отраслях, включая электронику, атомную энергетику и фармацевтику.
Основные составляющие атома цезия
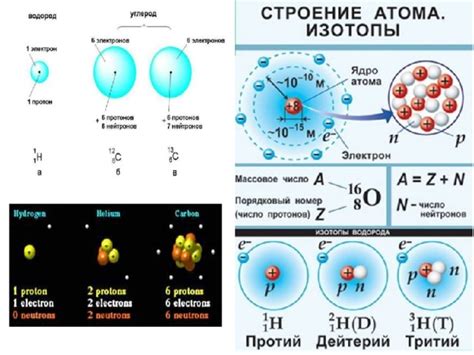
Атом цезия - это типичный металл, обладающий определенной структурой и составом. Он состоит из ядра, в котором содержатся протоны и нейтроны, и электронной оболочки, в которой находятся электроны. Ядро атома цезия содержит 55 частиц - 55 протонов и различное количество нейтронов в зависимости от изотопа.
Протоны являются положительно заряженными элементарными частицами и определяют химические свойства атома цезия. Электроны, в свою очередь, являются отрицательно заряженными частицами и образуют электронную оболочку атома. Количество электронов в атоме цезия равно числу протонов, так как атом электрически нейтрален.
Атом цезия также имеет несколько изотопов, которые отличаются количеством нейтронов в ядре. Самый распространенный и стабильный изотоп цезия - Cs-133, обладающий 78 нейтронами. Однако существуют и другие изотопы цезия, например, Cs-137, которые имеют большее количество нейтронов и обладают радиоактивными свойствами.
Таким образом, атом цезия состоит из ядра, содержащего 55 протонов и различное количество нейтронов, и электронной оболочки, в которой находятся 55 электронов. Эти основные составляющие атома цезия определяют его химические и физические свойства, которые делают его типичным металлом.
Масса, протоны и нейтроны
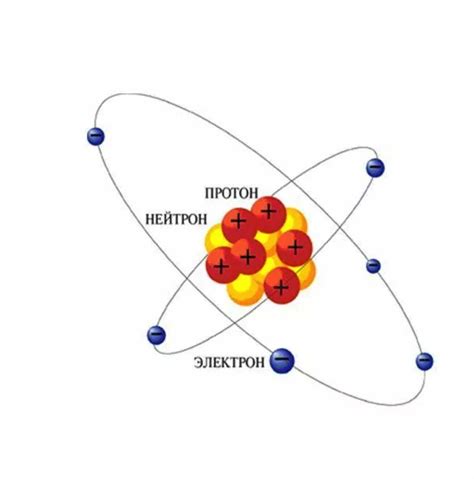
Цезий – элемент периодической таблицы, известный своей массой и свойствами металла. Его атомный номер равен 55, что означает присутствие в ядре 55 протонов. Протоны являются положительно заряженными частицами и определяют химические свойства атома. Вместе с ними в ядре цезия находится обычно 78 нейтронов.
Масса атома цезия составляет примерно 132,9 атомных единиц. Это объясняется тем, что масса атома складывается из масс протонов и нейтронов, которые обладают почти одинаковой массой. Протоны и нейтроны называются нуклонами и находятся в ядре атома.
Масса протона составляет примерно 1,67 × 10-27 килограмма, а масса нейтрона – примерно 1,67 × 10-27 килограмма. Следовательно, масса атома цезия может быть приближенно рассчитана, умножив массу одного нуклона на их общее количество в ядре. Нейтроны помогают увеличить массу ядра и повышают стабильность атома, несмотря на их отсутствие заряда.
Таким образом, масса, протоны и нейтроны являются важными характеристиками атома цезия и позволяют ему обладать типичными металлическими свойствами.
Электроны и электронная оболочка

Электроны - это отрицательно заряженные элементарные частицы, находящиеся вокруг атомного ядра и составляющие его электронную оболочку. Количество электронов в атоме определяет его электронную конфигурацию и его свойства.
Электроны располагаются в электронных оболочках, которые представляют собой уровни энергии. Каждая оболочка может содержать определенное количество электронов. Ближайшая к ядру оболочка называется первой, дальше идут вторая, третья и т.д. Каждая оболочка характеризуется своей энергией. Чем ближе к ядру находится оболочка, тем ниже ее энергетический уровень.
Интересно, что электроны располагаются на оболочках по принципу заполнения слоями. Это означает, что каждая оболочка заполняется поочередно, начиная с самой ближней к ядру, прежде чем заполнять следующую. Каждой оболочке соответствуют свои подуровни, такие как s, p, d, f. Количество электронов в каждом подуровне определяется формулой 2n², где n - номер оболочки.
Цезий, как и большинство металлов, имеет характерную электронную конфигурацию. Он имеет атомный номер 55, что означает, что у него на первых оболочках находится 2 электрона, затем на следующих оболочках 8 и 18 электронов соответственно. Оставшиеся 27 электронов заполняют оболочки с номерами 4 и 5. Благодаря такому расположению электронов цезий обладает хорошей проводимостью электричества и тепла, что делает его типичным металлом.
Основные свойства металлов
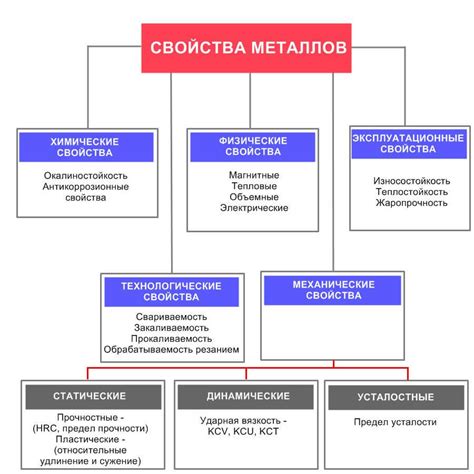
Электропроводность. Одним из основных свойств металлов является их высокая электропроводность. Металлы содержат свободные электроны, которые способны легко перемещаться в кристаллической решетке. Это делает металлы отличными проводниками электричества.
Теплопроводность. Металлы также обладают отличной теплопроводностью. Это связано с тем, что свободные электроны в металлах могут передавать тепло с одной части материала на другую. Благодаря этому свойству, металлы широко используются в промышленности, включая производство нагревательных элементов и радиаторов.
Пластичность и формоизменяемость. Металлы обладают способностью к пластическому деформированию и формоизменению. Они могут быть легко прокатаны, растянуты, свернуты и изготовлены в различные формы, без потери своих физических свойств. Благодаря этому свойству, металлы широко используются в производстве различных изделий.
Химическая реактивность. Металлы могут образовывать различные химические соединения, обладающие различными свойствами. Они имеют тенденцию окисляться при взаимодействии с кислородом, образуя оксиды. Некоторые металлы также способны вступать в реакцию с кислотами и образовывать соли.
Металлический блеск. Металлы обладают характерным блеском, называемым металлическим блеском. Он связан с способностью металлов отражать свет. Благодаря этому свойству, металлы часто используются в ювелирном и декоративном искусстве.
Магнитные свойства. Некоторые металлы обладают магнетическими свойствами. Они могут притягивать или отталкивать другие металлы или магнитные материалы. Это свойство используется в производстве магнитов и электромагнитов.
В целом, металлы обладают рядом уникальных свойств, которые делают их важным материалом во многих отраслях промышленности и науки.
Высокая тепло- и электропроводность

Цезий является типичным металлом, причем одной из его характеристик является высокая теплопроводность. Это означает, что цезий способен передавать тепло от одной частицы к другой с высокой эффективностью. Теплопроводность цезия объясняется его упорядоченной структурой и способностью его атомов свободно передвигаться в решетке кристалла.
Кроме того, цезий проявляет высокую электропроводность. Это связано с его способностью эффективно переносить электрический ток благодаря наличию свободных электронов внешней электронной оболочки. Электропроводность цезия особенно заметна при низких температурах, когда металл становится сверхпроводящим, т.е. способным передавать электрический ток без какого-либо сопротивления.
Высокая тепло- и электропроводность делает цезий востребованным металлом в различных областях, включая электронику, промышленность, а также в научных исследованиях. Его использование в электронных компонентах и приборах обеспечивает эффективность и надежность их работы, а также способствует энергосбережению.
Пластичность и формоизменяемость
Цезий - это типичный металл, обладающий высокой пластичностью и формоизменяемостью. Пластичность - это способность материала подвергаться без разрушения формовке и деформации под действием механического напряжения.
Цезий, как металл, обладает слабым электроотрицательностью и большими атомными радиусами. Это позволяет атомам цезия свободно скользить друг относительно друга под действием электрических сил, способствуя пластичности и формоизменяемости материала.
Кристаллическая решетка цезия содержит большие промежутки между атомами, которые легко заполняются атомами других элементов или имеют возможность двигаться внутри материала, позволяя цезию изменять форму без разрушения.
Благодаря своей пластичности и формоизменяемости, цезий может быть легко расплавлен, отлит и прокатан в различные формы и конструкции, используемые в разных отраслях промышленности.
Кроме того, пластичность и формоизменяемость цезия позволяют его использовать для создания различных электронных компонентов, таких как электроды и соединители, а также для производства специализированных частей, требующих точной формы и размеров.
Вопрос-ответ

Каково строение атома цезия?
Атом цезия состоит из ядра, которое содержит 55 протонов и разное количество нейтронов в разных изотопах. Вокруг ядра находятся электроны, которые движутся по шелевидным орбитам.
Почему цезий является типичным металлом?
Цезий является типичным металлом благодаря своим характерным свойствам. Он обладает блестящим металлическим блеском, ковкостью и хорошей электропроводностью. Кроме того, цезий имеет низкую температуру плавления и высокую плотность. Все эти факторы делают его представителем класса металлов.
