Щелочноземельные металлы - это элементы второй группы периодической системы, включающие бериллий, магний, кальций, стронций, барий и радий. Они обладают химическими свойствами, схожими с щелочными металлами, но имеют более высокие плотности и температуры плавления.
Самой важной характеристикой этих элементов является их степень окисления, которая указывает на количество электронов, которые элемент может отдать или принять при образовании химических связей. В щелочноземельных металлах степень окисления может быть положительной или равной нулю.
Бериллий, находящийся во второй группе, имеет в основном степень окисления +2, но также может иметь степень окисления +1 или 0. Магний имеет степень окисления +2, кальций +2, стронций +2, барий +2 и радий +2.
Степени окисления щелочноземельных металлов существенно влияют на их химические свойства и возможность образования соединений с другими элементами. Изучение переменных степеней окисления щелочноземельных металлов является важной задачей в химии и имеет применение в различных областях, включая металлургию, электрохимию и материаловедение.
Свойства и значения степеней окисления
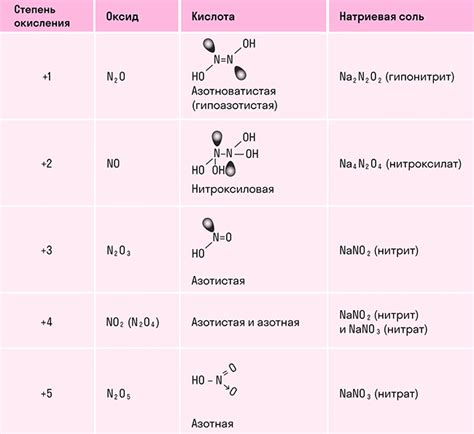
Степень окисления представляет собой числовое значение, которое отражает относительную электроотрицательность атома в оксидной или ионной форме в химическом соединении. Степень окисления указывает на количество электронов, которые атом получает или отдает при формировании соединения.
Возможные значения степени окисления щелочноземельных металлов в соединениях могут быть +2. Щелочноземельные металлы, такие как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), имеют два внешних электрона в своей валентной оболочке, и, соответственно, могут отдать два электрона при образовании ионного соединения. Основной окислительным состоянием для этих металлов является +2.
Часто встречаются также окислительные состояния совмещения, такие как +1 и +2. Например, бериллий (Be) может иметь окислительные состояния +2 и +1 в некоторых соединениях, в зависимости от степени окисления других элементов.
- Значение +2 имеют соединения, в которых щелочноземельный металл присутствует в форме двухвалентного катиона.
- Значение +1 могут иметь некоторые необычные соединения, в которых металл образует одновалентные катионы.
Значение степени окисления щелочноземельных металлов играет важную роль в определении их химической активности и реакционной способности. Она также определяет ряд свойств и возможности щелочноземельных металлов в химических процессах и применении в различных областях науки и техники.
Щелочноземельные металлы и их химические свойства

Щелочноземельные металлы – это элементы второй группы периодической системы, которые располагаются сразу после щелочных металлов. Включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Химические свойства щелочноземельных металлов во многом определяют их электронную структуру. Они имеют два электрона на внешнем энергетическом уровне, что делает их металлическими, но в то же время они менее реактивны, чем щелочные металлы.
Щелочноземельные металлы обладают высокой электроотрицательностью и электроположительным окислительным потенциалом. Они образуют оксиды, гидроксиды и соли, которые растворяются в воде и образуют щелочные растворы.
Кальций, стронций и барий принимают участие в реакциях образования солей, осаждения и ионного обмена. Они также широко применяются в различных отраслях промышленности, например, в производстве стекла, цемента и удобрений.
Один из наиболее известных представителей щелочноземельных металлов – магний. Он используется в производстве сплавов, металлических конструкций, магниевых сплавов и прочих изделий. Магний также имеет широкое применение в медицине и пищевой промышленности.
Перечень переменных степеней окисления щелочноземельных металлов

Щелочноземельные металлы являются элементами второй группы периодической таблицы. Они включают в себя бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Как и другие элементы, щелочноземельные металлы могут иметь переменные степени окисления, то есть способность принимать различное количество электронов при образовании ионов.
Наиболее распространенные степени окисления щелочноземельных металлов в соединениях составляют +2 и 0. Однако, некоторые из них могут образовывать соединения и с другими степенями окисления. Вот перечень переменных степеней окисления для каждого щелочноземельного металла:
- Бериллий (Be): +2
- Магний (Mg): +2
- Кальций (Ca): +2
- Стронций (Sr): +2
- Барий (Ba): +2
- Радий (Ra): +2
Как видно из перечня, степень окисления щелочноземельных металлов в ионах составляет +2. Это связано с их электронной конфигурацией и наличием двух валентных электронов в наружной энергетической оболочке. Благодаря этому свойству, щелочноземельные металлы обладают высокой реакционной способностью и являются важными компонентами различных соединений и материалов.
Однако следует отметить, что на ряду с переменными степенями окисления, щелочноземельные металлы также могут образовывать ионы с нулевой степенью окисления. Это связано с их способностью отдавать два электрона и образовывать ионы без изменения своей степени окисления.
Особенности переменных степеней окисления

Переменные степени окисления щелочноземельных металлов представляют собой особый аспект химической активности этих элементов. Они характеризуются способностью металлов из этой группы образовывать соединения с различными степенями окисления.
Одной из особенностей переменных степеней окисления щелочноземельных металлов является их способность к образованию оксидов с разными окислительными свойствами. Например, характерная для этой группы оксидов – щелочноземельных металлов свойство проявлять то основные, то кислотные свойства.
Переменные степени окисления щелочноземельных металлов определяются расположением элементов в периодической системе. Благодаря наличию вовнеэлектронной s-подобной подобноядерной электронной оболочки, переменные степени окисления тяжелых щелочноземельных металлов Cu и Ag характеризуются более широким диапазоном значений. В то же время, легкие щелочноземельные металлы Be, Mg и Ca имеют менее разнообразные степени окисления.
Особенности переменных степеней окисления щелочноземельных металлов имеют практическое значение в различных областях химии и применяются, например, в качестве информационного маркера при изучении химических реакций, электрохимического исследования электролитов, а также в процессе синтеза различных соединений и материалов.
Изменение степеней окисления в соединениях щелочноземельных металлов

Щелочноземельные металлы в периодической системе расположены во второй группе. Они включают бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Как и другие металлы, они способны образовывать соединения с другими элементами, принимая различные степени окисления.
Степень окисления (окислительное число) – это численное значение, указывающее на количество электронов, которые металл отдал или принял при образовании соединения. Щелочноземельные металлы обычно проявляют степени окисления +2, поскольку они имеют два валентных электрона в своей внешней электронной оболочке.
Однако, некоторые щелочноземельные металлы, такие как бериллий и магний, могут образовывать соединения с окислительным числом +1. Например, бериллий может образовывать соединения с фтором (BeF2) или хлором (BeCl2) с окислительным числом +2, но также может образовывать соединение с гидроксидом (Be(OH)2) с окислительным числом +1.
Изменение степеней окисления в соединениях щелочноземельных металлов связано с их способностью отдавать или принимать электроны при образовании связей с другими элементами. Это может быть вызвано различными факторами, такими как электроотрицательность атомов, наличие внешних электронных оболочек, растворимость и другие физико-химические свойства.
В итоге, изменение степеней окисления в соединениях щелочноземельных металлов позволяет им образовывать разнообразные соединения с различными химическими свойствами. Это делает их важными элементами для множества промышленных и научно-исследовательских процессов.
Применение переменных степеней окисления

Переменные степени окисления щелочноземельных металлов находят широкое применение в различных областях науки и техники.
В химической промышленности переменные степени окисления используются при производстве различных веществ. Например, магний с переменной степенью окисления +2 применяется для получения магниевых сплавов, которые используются в авиационной и автомобильной промышленности. Кальций с переменной степенью окисления +2 применяется при производстве цемента, стекла и керамики.
Также переменные степени окисления щелочноземельных металлов находят применение в электроэнергетике. Магниевый и кальциевый аккумуляторы используют магний и кальций в качестве электродов с переменной степенью окисления, что обеспечивает хорошую электропроводность и длительную работу аккумуляторов.
Кроме того, переменные степени окисления щелочноземельных металлов применяются в медицине. Кальций с переменной степенью окисления +2 играет важную роль в функционировании нервной системы и мышц, обеспечивает нормальное сокращение сердечной мышцы. Магний с переменной степенью окисления +2 также является необходимым элементом для работы многих ферментов и участвует в процессе синтеза ДНК и РНК.
Вопрос-ответ

Какие металлы относятся к щелочноземельным?
К щелочноземельным металлам относятся бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra).
Какие переменные степени окисления могут иметь щелочноземельные металлы?
Щелочноземельные металлы могут иметь переменные степени окисления +2 и иногда +1.
Зачем металлам нужны переменные степени окисления?
Переменные степени окисления позволяют металлам образовывать различные соединения с другими элементами и веществами, что расширяет их химические свойства и позволяет использовать их в различных процессах и реакциях.
