Степень окисления металлов является важным понятием в химии. Она определяет количество электронов, передаваемых металлом в химической реакции. Для определения степени окисления необходимо знать структуру атома металла и его свойства, что позволяет ответить на вопрос о том, где находится ответ на вопрос о степени окисления металлов.
Степень окисления металлов можно определить на основе их положения в периодической системе элементов. Однако, это не единственный критерий. Некоторые металлы могут иметь различные степени окисления в разных соединениях или в различных условиях. Поэтому для определения степени окисления металла необходимо учитывать не только его положение в периодической системе, но и другие факторы.
Важным инструментом для определения степени окисления металлов является анализ химических реакций, в которых участвуют данные металлы. Отслеживание потока электронов и изменений заряда атома металла в процессе реакции позволяет определить его степень окисления. Исследования проводятся с использованием различных методов, таких как спектроскопия и электрохимия, которые позволяют получить более точные данные о степени окисления металлов.
В итоге, степень окисления металлов определяется на основе их положения в периодической системе элементов, а также на основе анализа химических реакций и использования специальных методов исследования. Знание степени окисления металлов является важным для понимания и изучения химических реакций, а также для разработки новых материалов и применения металлов в различных отраслях промышленности.
Окисление металлов и его значение

Окисление металлов – это процесс, при котором металлический элемент вступает в реакцию с окислителем и теряет электроны. Окисление является неизбежным явлением для многих металлов, так как они стремятся достичь более устойчивого состояния, в котором имеют полный электронный оболочку.
Окисление металлов имеет большое значение в различных сферах жизни. Во-первых, это процесс, лежащий в основе электрохимических реакций, которые используются в батареях, аккумуляторах и других источниках электричества. Во-вторых, окисление металлов играет важную роль в процессах коррозии, что является серьезной проблемой для многих отраслей промышленности.
В окислительно-восстановительных реакциях металл, который теряет электроны и окисляется, называется веществом-окислителем. Окислитель способствует окислению другого вещества, которое выступает в роли восстановителя – того, который принимает электроны и становится восстановленным. Реакции окисления металлов встречаются повсеместно, начиная от простых химических реакций в природе до сложных процессов в технических системах.
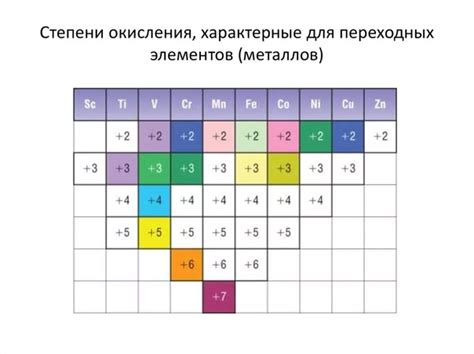
Важно отметить, что степень окисления металлов зависит от их положения в периодической системе элементов. Например, металлы в левой части периодической системы имеют тенденцию образовывать катионы с положительными зарядами, тогда как металлы в правой части имеют склонность к образованию анионов с отрицательными зарядами.
В заключение, окисление металлов – это важный процесс, который оказывает влияние на многие стороны нашей жизни и промышленности. Понимание степени окисления металлов и их реакций может помочь в различных областях, от производства электроэнергии до предотвращения коррозии.
Как определить степень окисления металлов?
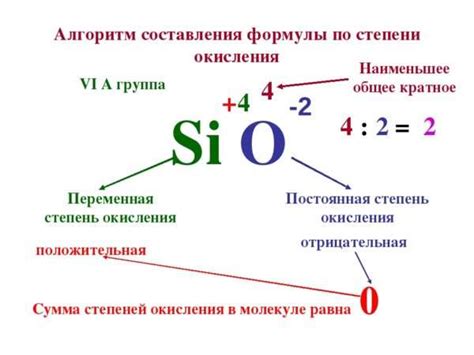
Определение степени окисления металлов в химии является важным понятием, которое позволяет понять, сколько электронов металл отдал или принял при образовании соединения. Степень окисления определяет химическую активность металла и его способность формировать ионы с различными зарядами.
Одним из способов определения степени окисления металлов является использование таблицы степеней окисления. В этой таблице указаны возможные значения степени окисления для каждого элемента в соединении. Например, для железа (Fe) возможны значения +2 и +3. При составлении формулы соединения нужно учесть суммарное значение степени окисления всех элементов должно быть равно нулю.
Другим способом определения степени окисления металлов является использование правил. Например, в большинстве неорганических соединений свободные металлы имеют степень окисления, равную нулю. Щелочные металлы (например, натрий и калий) в соединениях всегда имеют степень окисления +1, а щелочноземельные металлы (например, магний и кальций) имеют степень окисления +2.
Для определения степени окисления металла в сложных соединениях можно использовать электрохимические методы, такие как определение электропотенциала. Это позволяет определить, сколько электронов протекает через электрод в процессе окислительно-восстановительной реакции, и, соответственно, определить степень окисления металла.
Роль степени окисления металлов в химических реакциях

Степень окисления металлов играет важную роль в химических реакциях и определяет их характер. Она указывает на количество электронов, которые металл отдал или принял при окислении или восстановлении.
Когда металл окисляется, его степень окисления увеличивается, что означает потерю электронов. В этом случае металл является окислителем и участвует в окислительно-восстановительной реакции. Он отдает электроны другому веществу, которое восстанавливается (получает электроны) и изменяет свою степень окисления.
Когда металл восстанавливается, его степень окисления уменьшается, что означает получение электронов. В этом случае металл является восстановителем и также участвует в окислительно-восстановительной реакции. Он принимает электроны от другого вещества, которое окисляется (отдает электроны) и изменяет свою степень окисления.
Знание степени окисления металлов позволяет предсказать ход химической реакции и определить, какие вещества являются окислителями, а какие - восстановителями. Это позволяет контролировать реакции и использовать их в различных процессах, таких как электролиз, гальванические элементы, производство металлов и других химических соединений.
Практическое применение степени окисления металлов
Степень окисления металлов является важным понятием в химии и имеет практическое применение в различных областях. Она позволяет определить, сколько электронов металл отдал или принял при образовании ионов.
Одним из примеров практического применения степени окисления металлов является процесс гальванизации. В этом процессе степень окисления металла определяет его способность окислять или восстанавливать другие вещества. Это позволяет использовать гальваническую коррозию для защиты металла от окисления.
Степень окисления металлов также имеет значение в процессе электролиза. Она определяет направление движения электронов и позволяет выделить металл на катоде или аноде. Например, при электролизе раствора медного купороса медь выделяется на катоде, а ион меди снижает свою степень окисления и переходит на анод.
Кроме того, степень окисления металлов влияет на их химические свойства и способность образовывать соединения. Например, степень окисления металла может определять его способность образовывать соединения с определенным элементом или группой элементов. Так, применение степени окисления металлов активно используется в органической химии и биохимии для синтеза органических соединений и биомолекул.
В заключение, практическое применение степени окисления металлов включает использование ее для определения способности металла окислять или восстанавливать другие вещества, для электролиза и химического синтеза. Понимание степени окисления металлов позволяет улучшить производственные процессы, создавать новые соединения и обеспечивать защиту металла от окисления.
Вопрос-ответ

Как определить степень окисления металлов?
Степень окисления металлов можно определить по заряду, который имеет ион металла в соединении. Заряд иона является числом, которое показывает, сколько электронов металл отдал или принял в результате химической реакции.
Какое значение имеет степень окисления металлов в химических реакциях?
Степень окисления металлов играет важную роль в химических реакциях. Она определяет способность металла образовывать соединения и принимать участие в различных химических процессах. Кроме того, степень окисления металлов определяет их химические свойства и способность образовывать ионы.
