Степень окисления, также известная как степень валентности, является фундаментальным понятием в химии. Она определяет количество электронов, которые металл может потерять или приобрести при образовании химической связи. Знание степени окисления позволяет понять, как металл взаимодействует с другими химическими веществами, а также прогнозировать его химическую активность.
Определение степени окисления соединений с металлом основано на принципах электронного переноса и сохранения заряда. Когда металл образует химическую связь с другими веществами, он может отдать или принять электроны. Если металл отдаёт электроны, его степень окисления будет положительной. Если же металл принимает электроны, то его степень окисления будет отрицательной.
Знание степени окисления позволяет не только классифицировать соединения с металлом, но и определить их свойства и возможные реакции. Поэтому это важное понятие, которое входит в базу знаний химии и помогает понять многие процессы в химических реакциях.
Что такое степень окисления?
Степень окисления - это числовая характеристика, которая указывает на количество электронов, переданных атомом при участии в химической реакции. Она определяет, насколько атом или ион принимает или отдает электроны при образовании химических связей.
Степень окисления может принимать положительные, отрицательные или нулевые значения в зависимости от того, является ли атом окислителем или восстановителем в реакции. Положительное значение степени окисления означает потерю электронов, а отрицательное - приобретение электронов.
Для определения степени окисления атома в соединении необходимо учесть его электроотрицательность и общее число электронов, которые он образует с другими атомами. Чтобы прояснить ситуацию, можно использовать таблицы с электроотрицательностями элементов и известные правила определения степени окисления.
Изменение степени окисления атома может происходить как при переходе от одного соединения к другому, так и при внутренних перестройках молекулы. Знание степени окисления помогает понять, как происходят химические реакции, определить типы соединений и изучить их свойства.
Значение степени окисления в химии

Степень окисления (окислительное число) является одним из основных понятий в химии и играет важную роль в определении свойств и реакций химических соединений. Оно представляет собой числовую характеристику, которая отражает изменение заряда атома в процессе окисления или восстановления.
Степень окисления позволяет определить, какой электронный каркас окружает атом в химическом соединении, и насколько электроотрицательный или электроположительный данный атом. Это позволяет предсказывать реакции, свойства и химическую активность соединений.
Степень окисления определяется с помощью правил, которые указывают на изменение заряда атома при его окислении или восстановлении. Обозначается степень окисления атома с помощью римских цифр, причем отрицательные значения обозначаются со знаком "-" перед цифрой.
В химии степень окисления является основой для понимания реакций окисления-восстановления, которые играют важную роль в многих процессах, включая синтез и разложение веществ, реакции с газами, кислотами, основаниями и многие другие.
Знание степени окисления позволяет проводить расчеты и прогнозировать реакции в химических системах, определять продукты реакций и исследовать соединения в лабораторных условиях. Это важное понятие позволяет углубить знания о химической связи и структуре веществ, а также применять их в практических целях, например, при разработке новых материалов или лекарств.
Окислительно-восстановительные реакции
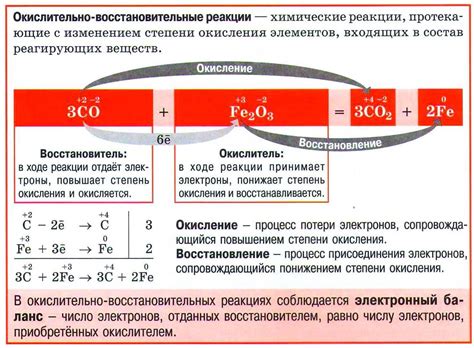
Окислительно-восстановительные реакции (ОВР) являются основным классом химических реакций, в которых происходит перенос электронов между реагирующими веществами. В таких реакциях одно вещество – окислитель – получает электроны, а другое вещество – восстановитель – отдает электроны.
ОКР могут происходить как в растворе, так и внутри электродной ячейки. В растворе ОКР могут происходить спонтанно, но для этого необходимо наличие соответствующих окислительных и восстановительных пар. В электродной ячейке ОКР происходят при протекании электрического тока через ячейку с помощью внешнего источника энергии.
Наиболее известными примерами окислительно-восстановительных реакций являются реакции, в которых участвуют основные химические элементы, такие как кислород, водород, и многоуровневые ионные соединения. Важной характеристикой ОВР является изменение степени окисления атомов, которое может быть определено с помощью правил степени окисления.
ОКР играют важную роль во многих областях, включая химическую промышленность, энергетику и биологию. Они находят применение в процессах получения различных веществ и материалов, а также в электрохимических системах, таких как аккумуляторы и гальванические элементы. Понимание окислительно-восстановительных реакций позволяет проводить различные анализы и рассчитывать электродные потенциалы в электрохимических системах.
Определение степени окисления

Степень окисления (окислительного или восстановительного действия) – это электрохимический показатель, характеризующий способность вещества вступать в окислительные или восстановительные реакции. Определение степени окисления является важной задачей в химии, поскольку позволяет установить химические свойства веществ и предсказать их реакционную способность.
Для определения степени окисления вещества необходимо учитывать изменение расположения электронов в атоме или ионе при реакции. Правила определения степени окисления позволяют установить знак и численное значение степени окисления для каждого атома или иона в химическом соединении.
Основные правила определения степени окисления включают в себя следующие шаги:
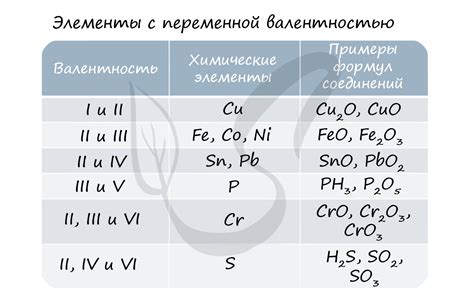
- В атоме или ионе, являющемся металлом, степень окисления равна его заряду. Например, степень окисления в ионе Fe2+ равна +2.
- В атомах несвязанных кислорода или фтора степень окисления равна -2.
- Водород обычно имеет степень окисления +1, за исключением гидридов металлов, где его степень окисления равна -1.
- В атомах ионов других элементов степень окисления рассчитывается из остальных правил и условий задачи.
Определение степени окисления вещества имеет широкое применение в химических реакциях, в расчетах электрохимических явлений, в обозначении имен химических соединений, а также в решении задач по химическому анализу и синтезу веществ.
Примеры степени окисления
1) Соединения с металлом в степени окисления +1:
Примеры: NaCl, KBr, AgNO3.
2) Соединения с металлом в степени окисления +2:
Примеры: MgO, CaCl2, FeO.
3) Соединения с металлом в степени окисления +3:
Примеры: AlCl3, FeCl3, CrCl3.
4) Соединения с металлом в степени окисления +4:
Примеры: SnCl4, PbO2, TiO2.
5) Соединения с металлом в степени окисления +5:
Примеры: SnCl2O, V2O5, CrO3.
6) Соединения с металлом в степени окисления +6:
Примеры: CrO2Cl2, MoO3, S2O6.
7) Соединения с металлом в степени окисления +7:
Примеры: Mn2O7, ReO3, HNO4.
8) Соединения с металлом в отрицательной степени окисления:
Примеры: NaH, LiAlH4, CaH2.
Вопрос-ответ

Как определить степень окисления соединений с металлом?
Степень окисления соединений с металлом можно определить, зная электроотрицательности элементов в соединении. Для этого нужно знать электроотрицательность металла и неметалла, и сравнить их. Если число металла больше, то его степень окисления будет положительной, а если число неметалла больше, то степень окисления будет отрицательной.
Зачем нужно знать степень окисления соединений с металлом?
Знание степени окисления соединений с металлом позволяет понять, как именно происходят окислительно-восстановительные реакции, а также предсказывать возможные взаимодействия элементов. Это важно для понимания механизмов реакций и применения в промышленности и научных исследованиях.
Какие бывают степени окисления металлов?
Степень окисления металлов может быть положительной, отрицательной и равной нулю. Положительная степень окисления означает, что металл отдает электроны, отрицательная - что металл принимает электроны, а степень окисления равная нулю означает, что металл находится в своем исходном состоянии.
