Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и др., являются элементами первой группы периодической системы. Они обладают особенными химическими свойствами, которые делают их очень активными и реактивными веществами.
Одной из характерных особенностей щелочных металлов является то, что они всегда имеют степень окисления +1. Это означает, что при образовании химических соединений щелочные металлы теряют один электрон и становятся положительно заряженными ионами.
Степень окисления - это число, которое указывает на изменение заряда атома при образовании соединения. В случае щелочных металлов, они всегда теряют один электрон и образуют ионы с положительным зарядом +1. Это связано с особенностями их электронной конфигурации и структурой атома.
Наличие постоянной степени окисления у щелочных металлов позволяет упростить химические расчёты и предсказать реактивность их соединений. Также это является основой для классификации и систематизации химических свойств этих элементов.
Определение степени окисления

Степень окисления – это числовая характеристика, показывающая, насколько атом данного элемента воздействует на электроны в химическом соединении. Щелочные металлы, такие как литий, натрий, калий, радий, обладают особой химической активностью и образуют соединения, в которых степень окисления атома металла всегда равна +1.
Определение степени окисления осуществляется на основе установленных правил. Если атому металла присоединена только одна электронная пара, то его степень окисления будет +1. Это связано с тем, что в щелочных металлах ядро обладает малым количеством электронов, и эти электроны находятся валентной оболочке. Поэтому, чтобы образовать стабильное химическое соединение, атом металла отдает один электрон другому элементу, приобретая положительный заряд.
Степень окисления щелочных металлов всегда равна +1 независимо от элемента, с которым они образуют соединение. Например, в соединении калий бромид (KBr) степень окисления калия равна +1, а в соединении натрий оксид (Na2O) степень окисления натрия также равна +1. Эта особенность связана с электронной конфигурацией атомов щелочных металлов и их стремлением образовать ион с положительным зарядом.
Щелочные металлы и их химические свойства
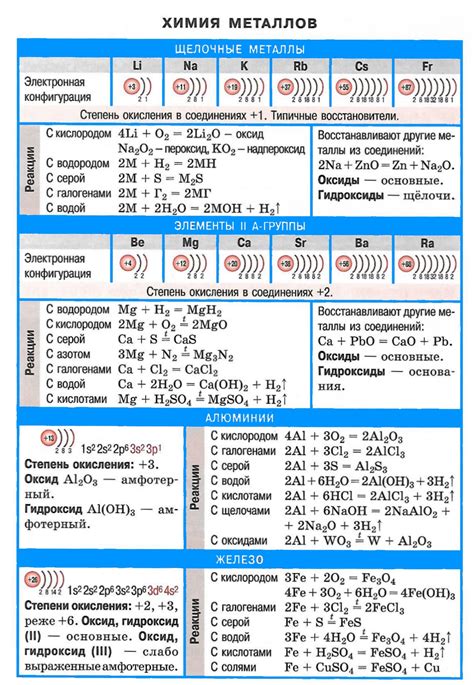
Щелочные металлы – это элементы химической группы 1 (IА по системе Менделеева), включающей литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются особым набором химических свойств, обусловленным их электронной конфигурацией и структурой.
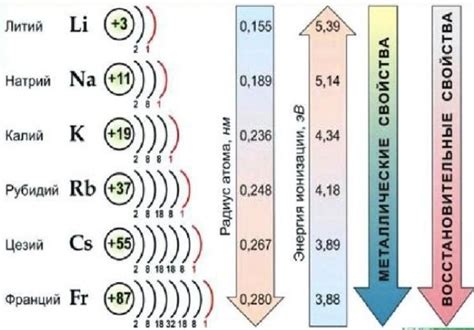
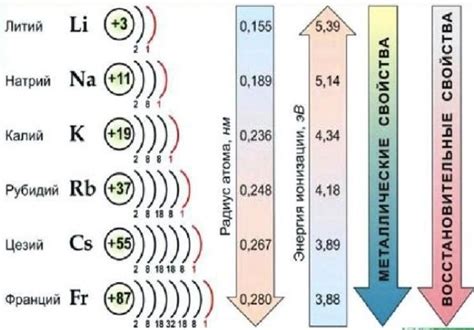
Примечательной особенностью щелочных металлов является их низкая ионизационная энергия, что делает их очень реактивными. Они легко образуют положительно заряженные ионы, теряя один электрон и образуя ионы с однозначным положительным зарядом.
Щелочные металлы проявляют высокую активность при взаимодействии с водой, образуя щелочь и выделяя водород. Натрий, калий и литий реагируют даже с водой воздуха, а рубидий и цезий – даже с водородом. Реакции щелочных металлов с кислородом приводят к образованию оксидов с высоким степенями окисления.
Степень окисления щелочных металлов всегда равна +1. Исключение составляет литий, у которого степень окисления может быть равна +1 или +2, в зависимости от условий реакции.
Также интересно отметить, что химические свойства щелочных металлов увеличиваются снизу вверх по группе. Литий, находящийся в верхней части группы, является наименее активным щелочным металлом, тогда как франций, находящийся в нижней части группы, является наиболее активным щелочным металлом.
В заключение стоит отметить, что щелочные металлы широко применяются в различных областях, включая производство щелочных батарей, сплавов, стекла, щелочных материалов и многого другого.
Основные правила определения степени окисления

Определение степени окисления щелочных металлов имеет свои определенные правила. Эти правила помогают установить, сколько электронов потерял или приобрел атом металла при образовании ионной связи.
1. Правило о сумме степеней окисления. Сумма степеней окисления всех атомов в молекуле или ионе равна заряду молекулы или иона. Например, в ионе NaCl сумма степеней окисления натрия и хлора равна 0, так как общий заряд иона равен 0.
2. Правило о степени окисления нереактивного атома. Степень окисления атома нереактивного элемента (элементов группы 18) всегда равна 0. Например, в молекуле O2 оба атома кислорода имеют степень окисления 0.
3. Правило о степени окисления кислорода. Степень окисления атома кислорода в большинстве случаев равна -2, за исключением пероксидов, где степень окисления кислорода равна -1. Например, в молекуле H2O степень окисления кислорода равна -2, а в молекуле H2O2 степень окисления кислорода равна -1.
4. Правило о степени окисления водорода. Степень окисления атома водорода всегда равна +1. Например, в молекуле H2O степень окисления водорода равна +1.
5. Правило о степени окисления атомов металлов. В неионных соединениях, степень окисления щелочных металлов (натрия, калия и др.) всегда равна +1.
Знание основных правил позволяет более точно определить степень окисления щелочных металлов и делать правильные выводы о химических реакциях, участвующих в образовании соединений.
Расчет степени окисления щелочных металлов
Степень окисления щелочных металлов является важным показателем, который позволяет определить, сколько электронов атом металла потерял или приобрел при образовании ионной связи. Зная степень окисления, можно определить ионный заряд металла и его химическое поведение.
Для расчета степени окисления щелочных металлов следует учитывать правила, согласно которым эти элементы обладают постоянной степенью окисления. Все щелочные металлы имеют степень окисления +1. Это означает, что в химических соединениях они всегда теряют один электрон и образуют ионы с положительным зарядом.
Примером может служить натрий (Na), который в соединениях всегда имеет степень окисления +1. Например, в хлориде натрия (NaCl) натрий теряет один электрон и образует ион Na+, а хлор принимает этот электрон и образует ион Cl-. Такая ионная связь позволяет образовывать стабильные химические соединения.
Однако следует отметить, что в некоторых соединениях щелочные металлы могут иметь и другие степени окисления. Например, в пероксидах калия и натрия (K2O2, Na2O2) калий и натрий имеют степень окисления +1 и +2 соответственно.
Таким образом, для расчета степени окисления щелочных металлов необходимо учитывать общее правило степени окисления +1, но не забывать о возможности других степеней окисления в некоторых соединениях.
Роль степени окисления в химических реакциях

Степень окисления щелочных металлов, таких как литий, натрий, калий, всегда равна +1. Эта особенность щелочных металлов имеет важное значение во множестве химических реакций, которые они могут участвовать. Степень окисления отражает изменение номера окислительного состояния атома щелочного металла в процессе реакции.
Окислительно-восстановительные реакции играют важную роль в химии и позволяют происходить переносу электронов между веществами. При этом щелочные металлы могут служить как окислителями, так и восстановителями. Например, в реакции с хлором литий окисляется до +1 степени окисления, а хлор восстанавливается. Таким образом, степень окисления щелочного металла не только определяет его активность в реакции, но и позволяет прогнозировать ход процесса.
Изменение степени окисления щелочных металлов также играет важную роль во многих других реакциях. Например, калий в воде окисляется до +1 степени окисления, при этом образуется гидроксид калия и выделяется водород. Эта реакция позволяет использовать калий в пиротехнике и для задержки огня.
Таким образом, степень окисления щелочных металлов имеет большое значение в различных химических реакциях. Она определяет активность металлов, их способность участвовать в окислительно-восстановительных процессах, а также влияет на результаты реакций и их полезные свойства.
Примеры степени окисления щелочных металлов
Щелочные металлы – это элементы первой группы периодической системы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают выраженными металлическими свойствами и хорошо растворяются в воде, образуя щелочные растворы.
Все щелочные металлы обладают одним общим свойством – всегда положительной степенью окисления. Это связано с тем, что при реакции с другими веществами щелочные металлы отдают электроны и образуют положительные ионы. При этом степень окисления щелочных металлов не меняется и всегда равна +1. Однако существуют и исключения, когда степень окисления щелочных металлов может быть отличной от +1.
Например, литий (Li) может образовывать ионы с положительной степенью окисления +1, а также с положительной степенью окисления +2, как в соединении Li2O2 (пероксид лития). Это связано с его малым размером и высокой электроотрицательностью, что позволяет литию получать дополнительные электроны.
Калий (K) и рубидий (Rb) могут образовывать ионы с положительной степенью окисления +2, как в соединении K2O2 (пероксид калия) и RbO2 (пероксид рубидия). Это также связано с их большими размерами и способностью получать дополнительные электроны.
В целом, степень окисления щелочных металлов всегда равна +1, однако некоторые исключения позволяют им образовывать ионы с более высокой степенью окисления, что обусловлено их особыми физическими и химическими свойствами.
Вопрос-ответ

Что такое степень окисления щелочных металлов?
Степень окисления щелочных металлов указывает на количество электронов, которые они могут потерять или передать другим элементам при образовании химической связи.
Почему степень окисления щелочных металлов всегда равна?
Степень окисления щелочных металлов всегда равна +1. Это связано с тем, что щелочные металлы имеют один валентный электрон в своей внешней энергетической оболочке и могут его легко отдать другим элементам.
Какую роль играет степень окисления щелочных металлов в реакциях окисления-восстановления?
Степень окисления щелочных металлов играет важную роль в реакциях окисления-восстановления, так как она указывает на количество электронов, которые могут быть переданы или приняты металлом. Это позволяет определить в каком состоянии находится металл (окисленное или восстановленное) и какие соединения он может образовать.
Может ли степень окисления щелочных металлов быть отрицательной?
Нет, степень окисления щелочных металлов не может быть отрицательной. Щелочные металлы всегда имеют положительную степень окисления, которая равна +1. Это связано с их электронной конфигурацией и способностью отдавать один электрон при образовании химических связей.
Влияет ли степень окисления щелочных металлов на их химическую активность?
Да, степень окисления щелочных металлов влияет на их химическую активность. Щелочные металлы с большей степенью окисления (например, +2) более активны и реакционноспособны, чем щелочные металлы с меньшей степенью окисления (например, +1). Это связано с тем, что более окисленные металлы имеют большую потенциальную энергию и, следовательно, большую активность в химических реакциях.
