В химии степень окисления (валентность) щелочноземельных металлов, таких как магний, кальций и барий, играет важную роль в определении их химических свойств и применений. Степень окисления указывает на количество электронов, которые металл может потерять при образовании соединений. Это свойство помогает определить реакционную способность и химические свойства этих металлов.
При определении степени окисления щелочноземельных металлов можно использовать различные методы и приборы. Один из наиболее распространенных методов - анализ окислительно-восстановительных реакций. При таком анализе металл растворяется в кислоте или реагирует с веществом, содержащим окислительное свойство. При этом происходит изменение степени окисления металла, которое можно заметить по изменению цвета раствора или образованию осадка.
Например, при реакции магния с кислотой магний окисляется из степени окисления +2 до +3, что приводит к образованию газа и изменению цвета раствора. В результате можно определить, что степень окисления магния равна +2.
Степень окисления щелочноземельных металлов имеет практическое применение в различных сферах. Например, магний, имеющий степень окисления +2, широко используется в производстве сплавов, прочных и легких материалов, а также в производстве лекарственных препаратов. Кальций, с степенью окисления +2, используется в качестве добавки в стекле и изготовлении строительных материалов. Барий, имеющий степень окисления +2, применяется в рентгеновской и ядерной медицине.
Что такое степень окисления щелочноземельных металлов?
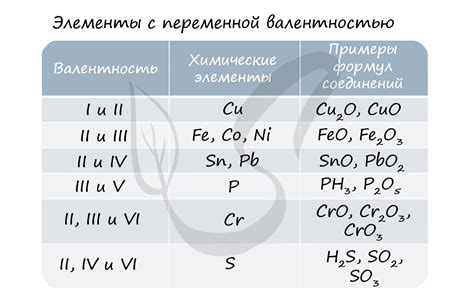
Степень окисления - это числовое значение, которое указывает на количество электронов, переданных атомом одного элемента другому в ходе химической реакции.
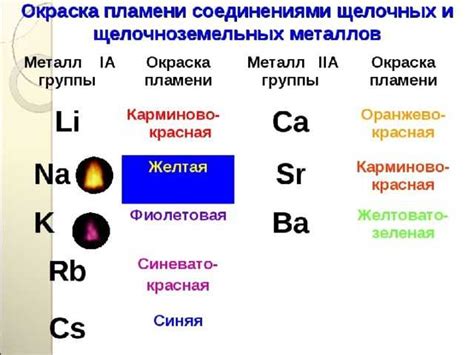
Щелочноземельные металлы - это элементы 2-й группы периодической системы: бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Они обладают двумя внешними электронами и часто образуют ионные соединения.
Степень окисления щелочноземельных металлов может быть положительной или отрицательной, в зависимости от того, переходят ли электроны с атомов металла на другой элемент или от другого элемента на атом металла. В большинстве случаев, щелочноземельные металлы теряют два электрона и имеют степень окисления +2 при образовании соединений.
Знание степени окисления щелочноземельных металлов важно при проведении различных химических реакций и расчете ионной формулы соединений. Оно позволяет определить, какие электроны участвуют в реакции и какие типы связей образуются между атомами элементов.
Определение степени окисления

Степень окисления щелочноземельных металлов является важным показателем их химической активности и способности образовывать соединения с другими элементами. Определение степени окисления щелочноземельных металлов осуществляется на основе их электронной конфигурации и особенностей взаимодействия с другими веществами.
Один из способов определения степени окисления щелочноземельных металлов заключается в анализе их валентностных электронов. Щелочноземельные металлы имеют два валентностных электрона во внешней оболочке, что соответствует степени окисления +2. Однако, при образовании соединений, щелочноземельные металлы могут потерять или получить дополнительные электроны, что приводит к изменению их степени окисления.
Для определения степени окисления щелочноземельных металлов в различных соединениях, можно использовать таблицу степеней окисления, в которой указаны наиболее распространенные соединения и их степени окисления щелочноземельных металлов. Также, можно обратиться к химическим формулам соединений и применить правила определения степени окисления для каждого элемента в соединении.
Наличие различных степеней окисления щелочноземельных металлов позволяет им образовывать разнообразные соединения с другими элементами. Знание степени окисления позволяет более точно описывать и анализировать химические реакции, участвующие щелочноземельными металлами, и применять их в различных областях науки и техники.
Методы определения степени окисления

Степень окисления щелочноземельных металлов может быть определена с использованием различных методов, основанных на химических реакциях и специальных аналитических методах. Некоторые из них включают:
- Окислительно-восстановительные реакции: Один из самых распространенных методов определения степени окисления щелочноземельных металлов - это применение окислительно-восстановительных реакций. При таких реакциях металлы могут получить степень окисления путем взаимодействия с ореолигандами или другими химическими веществами, которые претерпевают окисление или восстановление.
- Спектроскопия: Спектроскопические методы также широко используются для определения степени окисления щелочноземельных металлов. Эти методы основаны на измерении поглощения или излучения света, который проходит через образец металла. Кривые поглощения или излучения могут быть анализированы для определения характеристик атомов и структуры вещества, включая его степень окисления.
- Электрохимические методы: Электрохимические методы, такие как вольтамперометрия и потенциостатика, могут быть использованы для определения степени окисления щелочноземельных металлов. Эти методы основаны на измерении электрических потенциалов и токов, происходящих во время электрохимических реакций, вызванных переходом электронов между окисленным и восстановленным состояниями металла.
- Инструментальные методы: Дополнительных информацию о степени окисления щелочноземельных металлов можно получить с использованием инструментальных методов, таких как ядерный магнитный резонанс (ЯМР) и масс-спектрометрия (МС). Эти методы позволяют наблюдать и измерять характеристики атомов и молекул, что дает возможность определить степень окисления металла.
Целью использования указанных методов является определение степени окисления щелочноземельных металлов, что позволяет лучше понять их химические свойства и потенциальные применения в различных областях науки и технологий.
Применение степени окисления

Степень окисления щелочноземельных металлов имеет широкое применение в различных областях науки и техники.
Один из способов использования степени окисления заключается в определении химических соединений, в которых щелочноземельные металлы играют роль катионов. Знание степени окисления позволяет определить химическую формулу соединения и установить его свойства и реактивность.
Ещё одним применением степени окисления является вычисление количества электронов, переходящих между атомами в химическом соединении. Это необходимо для балансирования химических уравнений и проведения расчетов в химических реакциях.
Степень окисления также применяется для определения степени восстановления или окисления щелочноземельных металлов в химических процессах. Это важно для контроля качества продуктов и определения эффективности химических реакций.
Кроме того, знание степени окисления щелочноземельных металлов является необходимым для понимания и исследования различных физических и химических свойств этих металлов, их соединений и соединений, которые они образуют с другими элементами.
Таким образом, применение степени окисления щелочноземельных металлов играет ключевую роль в химической науке и позволяет решать широкий спектр задач, связанных с изучением и применением этих важных элементов.
Степень окисления в химических реакциях

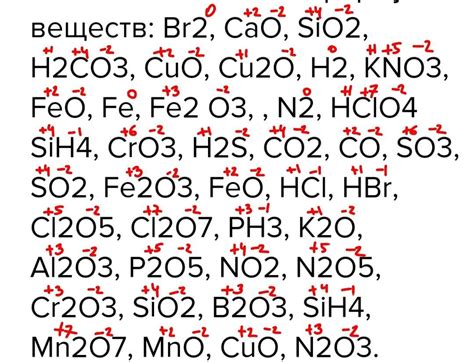
Степень окисления является одним из основных понятий в химии, описывающим степень окислительных или восстановительных свойств атома или группы атомов в химическом соединении. Она обозначает число, которое показывает, сколько электронов атом передал или принял при образовании соединения.
Степень окисления играет важную роль в определении химической активности и реакционной способности веществ. Она также помогает определить тип химической реакции и понять химическую связь между атомами в соединении.
Степень окисления щелочноземельных металлов, таких как магний, кальций и другие, может быть определена с помощью различных методов, включая анализ электронного строения атома, положение в периодической системе элементов и знание химических свойств соединения.
Применение степени окисления щелочноземельных металлов в химических реакциях может быть связано с их способностью образовывать соединения с различными степенями окисления. Это может быть полезно в таких процессах, как образование солей, растворение в воде, образование сложных соединений и другие.
Таким образом, степень окисления щелочноземельных металлов имеет важное значение в химии и может быть определена и применена для более глубокого понимания и изучения различных химических реакций и свойств веществ.
Окислительно-восстановительные свойства

Окислительно-восстановительные свойства щелочноземельных металлов определяют их способность взаимодействовать с другими веществами путем передачи или приобретения электронов. Это свойство является одной из важнейших характеристик этих металлов и активно применяется в различных областях.
Щелочноземельные металлы проявляют окислительные свойства, то есть они способны отдавать электроны и вступать в реакции с веществами, которые имеют больше электроотрицательность. При этом металл сам становится окисленным и образует положительные ионы. Окислительные свойства этих металлов определяют их способность протекать реакции восстановления, обратные окислительным.
Восстановительные свойства щелочноземельных металлов заключаются в их способности получать электроны от веществ, обладающих меньшей электроотрицательностью. При взаимодействии с веществами, способными принять электроны, металлы становятся восстановленными и образуют отрицательные ионы. Восстановительные свойства щелочноземельных металлов могут быть использованы, например, в процессах электролиза и при получении различных соединений и веществ.
Влияние степени окисления на свойства металлов

Степень окисления является важным параметром для определения свойств металлов, особенно щелочноземельных. Этот параметр описывает количество электронов, которые металл отдает или принимает при образовании оксидной формы.
Изменение степени окисления может заметно влиять на различные свойства металлов, включая их физические и химические характеристики. Например, повышение степени окисления может привести к увеличению твердости и прочности металла. Это объясняется тем, что при окислении металл образует более крепкие химические связи между атомами.
Кроме того, степень окисления влияет на электропроводность металлов. Металлы с низкой степенью окисления обладают хорошей электропроводностью, так как образуют ионные связи с меньшими зарядами. В то же время, повышение степени окисления может привести к образованию ионов с более высокими зарядами, что снижает электропроводность.
Одним из применений знания степени окисления металлов является создание специальных сплавов. Изменяя степень окисления различных металлов, можно достичь желаемых свойств, таких как магнитная или термическая эффективность. Такие сплавы широко используются в различных отраслях промышленности, включая электронику и авиацию.
В заключение, степень окисления является важным параметром для определения свойств металлов, таких как твердость, электропроводность и химическая активность. Изменение степени окисления позволяет создавать специальные сплавы с желаемыми характеристиками. Понимание этого параметра позволяет оптимизировать процессы производства и применения металлургических материалов.
Вопрос-ответ

Что такое степень окисления щелочноземельных металлов?
Степень окисления щелочноземельных металлов указывает на количество электронов, которые щелочноземельный металл при этом приобретает или теряет. Она помогает определить, в каком состоянии находится металл и какие химические реакции он может совершать.
Как определить степень окисления щелочноземельных металлов?
Степень окисления щелочноземельных металлов можно определить по их месту в периодической системе элементов. Например, металлы первой группы (бериллий, магний, кальций и т.д.) имеют степень окисления +2, так как они имеют два электрона во внешней оболочке и могут терять их, образуя двухвалентные ионы. Металлы второй группы (стронций, барий и т.д.) имеют степень окисления +2, так как они имеют два электрона во внешней оболочке, но с меньшей склонностью к потере электронов.
Как можно применить степени окисления щелочноземельных металлов в химических реакциях?
Знание степени окисления щелочноземельных металлов позволяет предсказывать их реакционную способность и взаимодействие с другими веществами. Например, металлы первой группы, имеющие степень окисления +2, могут легко вступать в реакции окисления, образуя ионы с положительным зарядом, а металлы второй группы, имеющие степень окисления +2, вступают в реакции с меньшей склонностью. Это знание важно при проведении лабораторных экспериментов и в индустрии.
Что определяет степень окисления щелочноземельных металлов?
Степень окисления щелочноземельных металлов определяется количеством электронов, которые металл при этом приобретает или отдает. Так, металлы первой группы (бериллий, магний, кальций и т.д.) имеют степень окисления +2, так как они имеют два электрона во внешней оболочке и могут терять их при реакциях. Металлы второй группы (стронций, барий и т.д.) имеют степень окисления +2, но имеют меньшую склонность терять электроны по сравнению с металлами первой группы.