Степень окисления металлов - это числовое значение, которое показывает количество электронов, потерянных или полученных атомом металла во время окислительно-восстановительных реакций. Она является важной характеристикой металла, определяющей его химические свойства и способность участвовать в различных химических реакциях.
Определение степени окисления металлов основано на следующих принципах. В первую очередь, несколько элементарных веществ (атомов) с одинаковым химическим элементом не могут иметь одинаковую степень окисления. Степень окисления каждого элемента в соединении должна быть определена таким образом, чтобы их сумма равнялась нулю или заряду иона суммы окисляющего и восстанавливающего агента.
Пример:
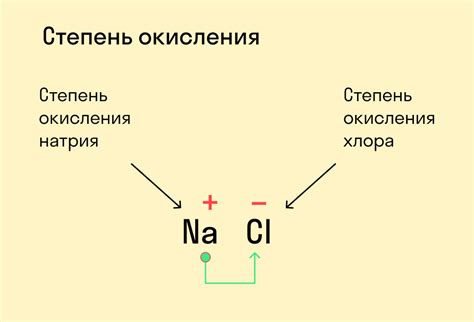
Рассмотрим соединение NaCl (хлорид натрия). Степень окисления натрия (Na) в соединении равна +1, т.к. натрий отдает один электрон при образовании соединения. Степень окисления хлора (Cl) равна -1, т.к хлор получает один электрон при образовании соединения. Сумма степеней окисления Na и Cl равна нулю, что соответствует электрической нейтральности соединения.
Использование степени окисления металлов позволяет определить направление и интенсивность химических реакций, а также предсказать продукты реакции. Она является важным инструментом для понимания химических процессов и проведения различных лабораторных исследований.
Определение степени окисления металлов
Определение степени окисления металлов является важным шагом в изучении химических реакций и реакционной способности различных металлических элементов. Степень окисления металла показывает, сколько электронов он потерял или получил при вступлении в химическую реакцию.
Степень окисления металлов можно определить на основе электрохимического ряда активности металлов. В этом ряду металлы располагаются по убыванию их способности отдавать или принимать электроны. Металлы с положительной степенью окисления способны отдавать электроны и окисляться, в то время как металлы с отрицательной степенью окисления способны принимать электроны и восстанавливаться.
Для определения степени окисления металлов также используется знание об ионной зарядности металла и его соединений. Знание зарядности ионов металла позволяет определить, сколько электронов металл потерял или получил. Если ионическая зарядность известна, то степень окисления легко определить по числу электронов, которые вступают в химическую реакцию.
Определение степени окисления металлов играет важную роль в понимании и предсказании реакций, связанных с металлами. В химических уравнениях степень окисления металла обозначается римскими цифрами и позволяет точно указать его электронную конфигурацию и роль в реакции.
Сущность и принципы
Степень окисления металлов – это параметр, отражающий число электронов, переданных атомом металла при образовании соединения. Степень окисления определяет способность металла к химическим реакциям и его роль в образовании соединений.
Основными принципами определения степени окисления металлов являются:
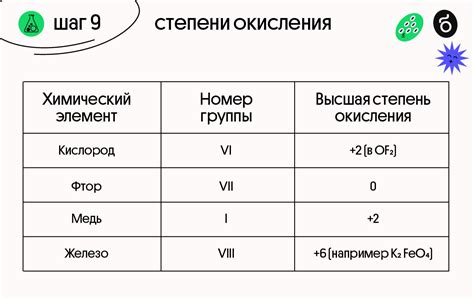
- Правило электропривлекательности. Чем выше электроположительность металла, тем ниже его степень окисления. Например, атомы щелочных металлов (натрий, калий и др.) имеют степень окисления +1, так как они имеют высокую электроположительность и легко отдают один электрон.
- Правило нейтралитета соединения. Сумма степеней окисления атомов, составляющих ион или молекулу, должна быть равна заряду иона или нулю для нейтральных соединений. Например, в хлориде натрия (NaCl) натрий имеет степень окисления +1, а хлор – степень окисления -1, что в сумме даёт ноль.
- Правило типовых соединений. Некоторые металлы образуют стандартные соединения с определенными степенями окисления. Например, железо может иметь степень окисления +2 (Fe2+) или +3 (Fe3+), в зависимости от вида соединения.
Определение степени окисления металлов является важной задачей в химии, так как она помогает понять роль металла в химических реакциях и свойствах соединений. Знание принципов определения степени окисления металлов позволяет предсказывать химические свойства и реактивность различных соединений.
Основные примеры степени окисления
Степень окисления металлов определяется их химическими свойствами и возможностью образования ионов. Каждый металл имеет свою характеристическую степень окисления, которая может варьироваться в зависимости от условий реакции.
Один из основных примеров степени окисления - железо. В состоянии окисления +2 оно образует ионы Fe2+, а в состоянии окисления +3 - ионы Fe3+. Эти ионы играют важную роль в множестве биологических процессов, а также используются в промышленности для производства стали и других материалов.
Другим примером является медь. В состоянии окисления +1 она образует ионы Cu+, а в состоянии окисления +2 - ионы Cu2+. Медь широко используется в электротехнике и гальванике, а также в производстве многочисленных медных сплавов.
Алюминий имеет степень окисления +3 и образует ионы Al3+. Этот металл широко используется в производстве легких и прочных материалов, таких как алюминиевые сплавы и фольга.
Еще одним примером степени окисления является свинец. В состоянии окисления +2 он образует ионы Pb2+. Свинец используется для производства аккумуляторов, сплавов и в других отраслях промышленности.
Важно понимать, что степень окисления металлов может изменяться в зависимости от конкретной химической реакции, поэтому эти примеры являются лишь общими указаниями на основные возможности окисления металлов.
Роль степени окисления в химических реакциях

Степень окисления металлов играет важную роль в химических реакциях. Она определяет, сколько электронов металл может отдать или принять при взаимодействии с другими веществами.
В химических реакциях металлы могут участвовать в окислительно-восстановительных процессах, где они либо окисляются, теряя электроны, либо восстанавливаются, получая электроны от других веществ. Степень окисления металла позволяет определить, какая именно реакция происходит.
Например, если металл имеет положительную степень окисления, это означает, что он может отдать электроны и окисляться. Такие металлы являются окислителями и могут реагировать с веществами, которые могут принять эти электроны и восстановить металл. Это позволяет использовать металлы в процессе гальванических элементов или электролиза.
С другой стороны, металлы с отрицательной степенью окисления могут принять электроны и восстановиться. Такие металлы называют восстановителями и способны реагировать с окислителями, отдавая им электроны. Это позволяет использовать эти металлы в качестве катализаторов или восстановительных агентов.
Знание степени окисления металлов позволяет понять, какие реакции могут происходить и какие вещества могут взаимодействовать с металлами. Это важно для понимания механизмов химических реакций и разработки новых материалов и технологий.
Методы определения степени окисления

Определение степени окисления металлов является важной задачей в химическом анализе. Существует несколько методов, которые позволяют точно определить степень окисления металла в соединениях. Один из таких методов - визуальное определение с помощью цветного индикатора.
Цветной индикатор - это вещество, которое меняет цвет в зависимости от степени окисления металла. Например, для определения степени окисления железа можно использовать индикатор феррина. При переходе железа из двухвалентного состояния в трехвалентное, цвет индикатора меняется с желтого на синий.
Еще одним методом определения степени окисления является рентгеноструктурный анализ. С помощью рентгеновских лучей можно изучать кристаллическую структуру вещества и определить состояние металла. Этот метод позволяет получить детальную информацию о расположении атомов в молекуле и определить, какой элемент находится в окисленном состоянии.
Также для определения степени окисления металла часто используются методы спектроскопии. Например, спектроскопия с использованием ультрафиолетового или видимого света позволяет определить характерные пики и линии в спектре, которые соответствуют определенному состоянию окисления. Измеряя интенсивность этих пиков, можно определить степень окисления металла в соединении.
Таким образом, существуют разные методы определения степени окисления металлов, которые основаны на визуальном анализе с помощью цветных индикаторов, рентгеноструктурном анализе или спектроскопии с использованием различных видов света. Комбинирование этих методов позволяет достичь более точных результатов и улучшить понимание окислительно-восстановительных процессов в химических реакциях.
Вопрос-ответ

Как определить степень окисления металлов?
Степень окисления металлов определяется по заряду, который металл ион образует при образовании соединения. Например, если металл образует ион со зарядом +2, то его степень окисления равна +2.
Какие металлы имеют степень окисления +1?
Некоторые металлы, такие как литий, натрий и калий, имеют степень окисления +1. Это связано с тем, что эти металлы имеют только один электрон во внешней оболочке и готовы отдать его, чтобы достичь стабильной конфигурации.
Какие примеры металлов с различными степенями окисления вы можете привести?
Один из примеров - железо. Оно может иметь степень окисления +2, как в соединении FeO, и +3, как в соединении Fe2O3. Еще один пример - медь. У нее степени окисления +1 в соединении CuCl и +2 в соединении CuO.
