Степень окисления щелочных металлов – это основная характеристика, описывающая количество электронов, участвующих в химических реакциях, на внешнем энергетическом уровне атома данного металла. Щелочные металлы такие, как литий, натрий, калий, рубидий и цезий, относятся к элементам главной группы периодической системы химических элементов.
На внешнем энергетическом уровне, который является самым высокоэнергетическим для этих атомов, окислению подвергается один электрон. Именно этот электрон является ответственным за проявление основных химических свойств щелочных металлов, таких как высокая активность, способность взаимодействия с водой и образование катионов.
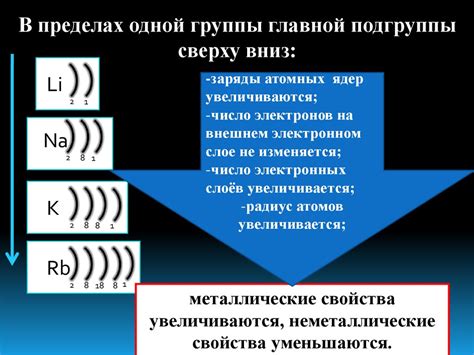
Степень окисления щелочных металлов указывает на их готовность отдать один электрон и образовать положительные ионы, что обуславливает их реакционную активность. Чем ниже положение металла в периодической системе, тем выше степень окисления. Например, литий имеет степень окисления +1, в то время как цезий – +1. Характеристика степени окисления щелочных металлов позволяет предсказать и объяснить их химическое поведение.
Степень окисления щелочных металлов имеет большое значение в различных областях науки и техники, так как они широко применяются в разных отраслях нашей жизни. Например, литий используется в производстве аккумуляторов, натрий – в производстве стекла и соды, калий – в удобрениях для сельского хозяйства. Изучение степени окисления щелочных металлов позволяет более точно контролировать и оптимизировать процессы производства и использования данных металлов.
Таким образом, степень окисления щелочных металлов на внешнем энергетическом уровне представляет собой фундаментальный параметр, определяющий их химические свойства и приложения в различных сферах нашей жизни.
Степень окисления щелочных металлов
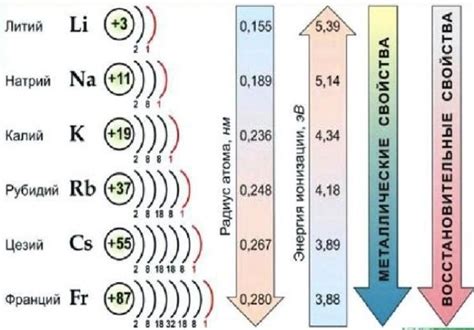
Щелочные металлы - это элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к самым реактивным металлам и обладают высокой активностью.
Степень окисления щелочных металлов на внешнем энергетическом уровне всегда составляет +1. Это связано с тем, что у них валентная оболочка содержит одну электрон в s-подуровне. Это электрон легко отдается, образуя положительный ион.
Активность щелочных металлов обусловлена их способностью легко отдавать этот электрон и образовывать ионы с положительным зарядом. Это делает их хорошими катионами и участвующими во многих химических реакциях.
Степень окисления щелочных металлов может изменяться, если они образуют соединения, в которых электрон из валентной оболочки переходит на другой атом. В таком случае степень окисления может быть, например, +2 или даже +3, в зависимости от количества переданных электронов.
Знание степени окисления щелочных металлов очень важно при изучении их химических свойств и реакций. Это позволяет предсказать и объяснить их способность образовывать ионы и соединения с другими элементами.
Щелочные металлы: общая информация

Щелочные металлы - это элементы, относящиеся к первой группе периодической таблицы элементов. Они включают в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы отличаются высокой активностью, связанной с наличием одного свободного электрона на внешнем энергетическом уровне.
Щелочные металлы обладают химическими свойствами, обусловленными наличием этого свободного электрона. Именно он позволяет щелочным металлам образовывать соединения с другими элементами, в том числе неорганическими кислотами и галогенами.
Природные щелочные металлы сильно реактивны и редко встречаются в природе в чистом виде. Они хорошо растворимы в воде и образуют щелочи, отсюда их название. Кроме того, щелочные металлы имеют низкую плотность и низкую температуру плавления.
Щелочные металлы широко используются в различных отраслях промышленности. Например, натрий используется в производстве стекла и мыла, калий - в удобрениях и взрывчатых веществах, литий - в производстве аккумуляторов и лекарственных препаратов.
- Литий (Li): находится в основном в минералах пегматита, грубого материала, состоящего из хорошо различимых кристаллических зерен. Широко применяется в легкомашиностроении, засчет неприлипаемости и устойчивости к морозам. В природе распространен в виде оксидов, гидроксидов и карбонатов.
- Натрий (Na): соли натрия когда-то использовали в качестве пищевых консервантов и красителей. Натрий нашел применение в производстве натрия, а также в производстве лаков, эмалей, мыла.
- Калий (K): используется в сельском хозяйстве для приготовления удобрений. По множеству других свойств калий также является важным питательным элементом для начального роста растений.
- Рубидий (Rb): встречается в основном в минералах пегматита (получаем из руды). Широко используется в производстве лекарственных препаратов.
- Цезий (Cs): имеет очень сильную флуоресценцию, имеет ярко голубой краситель, применяется в рентгенологии и других областях, связанных с работой лазера;
- Франций (Fr): является наиболее редким щелочным металлом и самым реактивным из всех щелочных металлов. Так как франций обладает высокой реактивностью и коротким временем полураспада, его очень трудно исследовать и использовать в практических целях.
Щелочные металлы играют важную роль и в биологических системах. Например, натрий и калий необходимы для нормальной работы клеток и тканей организма, а литий используется в лекарственных препаратах для лечения некоторых психических расстройств.
Внешний энергетический уровень
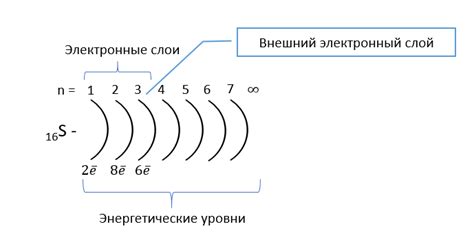
Внешний энергетический уровень – это энергетический уровень атома, на котором располагаются его внешние электроны. Вместе с внешним уровнем образуется внешняя оболочка атома, которая содержит эти электроны. Важно отметить, что количество электронов на внешнем энергетическом уровне определяет степень окисления атома.
Для щелочных металлов, таких как литий, натрий и калий, внешний энергетический уровень содержит один электрон. Это делает их очень реакционноспособными, так как они стремятся отдать этот электрон и достичь стабильной октаэдрической конфигурации. Щелочные металлы имеют степень окисления +1, так как они готовы отдать свой единственный электрон при взаимодействии с другими элементами.
Еще одной важной характеристикой внешнего энергетического уровня щелочных металлов является его энергия. Чем ближе энергия внешнего энергетического уровня к ядру, тем труднее оторвать электрон от атома. В случае щелочных металлов эта энергия минимальна, что делает их легко окисляемыми элементами.
Взаимодействие щелочных металлов с другими элементами происходит путем передачи их внешнего электрона. На внешний энергетический уровень щелочных металлов может влиять также наличие электронного возбуждения или наличие внешнего поля, которое способно изменить энергию этого уровня и внести изменения в степень окисления. Однако степень окисления щелочных металлов на внешнем энергетическом уровне большинство времени остается +1, что является характерной особенностью этих элементов.
Окисление щелочных металлов
Окисление щелочных металлов - это процесс, при котором атомы щелочных металлов теряют один или несколько электронов на внешнем энергетическом уровне. В результате этого процесса щелочные металлы образуют положительные ионы, так как их атомы становятся неэлектронейтральными.
Степень окисления щелочных металлов на внешнем энергетическом уровне зависит от количества электронов, которые они теряют. Например, натрий имеет один электрон на внешнем энергетическом уровне, поэтому при окислении превращается в положительный ион со степенью окисления +1.
Другим примером щелочного металла является калий, у которого на внешнем энергетическом уровне находится один электрон. Окисление калия приводит к образованию положительного иона с степенью окисления +1.
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, хорошо реагируют с кислородом и другими химическими веществами, что является следствием их высокой реакционной способности. Это делает щелочные металлы важными элементами для различных промышленных и научных целей.
Степень окисления на внешнем энергетическом уровне
Степень окисления - это характеристика, определяющая количество электронов, которые атом или ион потерял или получил в соединении. Она позволяет определить окислительно-восстановительные свойства вещества и его реакционную способность.
В случае щелочных металлов (литий, натрий, калий, рубидий, цезий) степень окисления на внешнем энергетическом уровне составляет +1. Это означает, что эти металлы способны отдавать один электрон и образовывать положительные ионы с однозначным зарядом.
Присутствие одной валентной электронной оболочки в атоме щелочных металлов делает их очень реакционноспособными. Они легко вступают в химические реакции, образуя соли и ионы. В реакциях с окислителями, щелочные металлы окисляются, отдавая электроны, и при этом изменяют свою степень окисления.
Однако степень окисления на внешнем энергетическом уровне не является постоянной для всех соединений щелочных металлов. Например, в пероксидах щелочных металлов (Li2O2, Na2O2, KO2) степень окисления кислорода равна -1, а всего вещества -1. Здесь кислород принимает дополнительные электроны, а щелочные металлы - отдают лишние электроны.
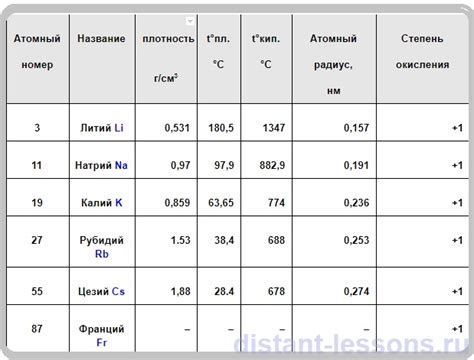
Таблица степеней окисления щелочных металлов:
| Металл | Степень окисления |
|---|---|
| Литий | +1 |
| Натрий | +1 |
| Калий | +1 |
| Рубидий | +1 |
| Цезий | +1 |
Знание степени окисления щелочных металлов на внешнем энергетическом уровне является важным для понимания и предсказания их реакционной способности и получения соответствующих соединений.
Применение степени окисления для определения свойств щелочных металлов

Степень окисления – это показатель электрического заряда, который принадлежит атому или иону в соединении. Щелочные металлы в периодической системе находятся в первой группе и обладают особенностями, связанными с их степенью окисления.
Определение степени окисления жизненно важно при изучении свойств щелочных металлов. К примеру, степень окисления натрия составляет +1, а для калия она равна +1. Изучение этих значений позволяет понять, что щелочные металлы имеют способность образовывать положительные ионы.
Степень окисления щелочных металлов влияет на их реакционную активность и способность образовывать соединения с другими элементами. Это объясняется тем, что положительный заряд иона щелочного металла притягивает отрицательно заряженные частицы окружающих элементов.
Благодаря определению степени окисления щелочных металлов можно прогнозировать их реакционную способность, химические свойства и поведение в процессе образования соединений. Эта информация особенно важна во многих отраслях, включая химическую промышленность, фармацевтику, энергетику и многие другие.
Вопрос-ответ

Какие металлы относятся к щелочным?
К щелочным металлам относятся литий, натрий, калий, рубидий, цезий и франций.
Что означает понятие "степень окисления"?
Степень окисления - это формальный заряд атома в веществе или ионе, определяющий его способность к окислению или восстановлению.
Какую степень окисления имеют щелочные металлы на внешнем энергетическом уровне?
Все щелочные металлы имеют степень окисления +1 на внешнем энергетическом уровне.
Почему щелочные металлы имеют степень окисления +1?
Степень окисления щелочных металлов равна +1, потому что на внешнем энергетическом уровне у них находится один электрон, которому нужно отдать один электрон для достижения стабильной конфигурации.
