Окисление - это химический процесс, в ходе которого атом или ион теряет электроны. Степень окисления определяет количество электронов, которые переходят от одного вида атома к другому при образовании химической связи. В то время как у большинства элементов степень окисления может варьироваться в зависимости от условий, у металлов она всегда постоянна и предсказуема.
Металлы характеризуются своей способностью отдавать электроны и образовывать положительно заряженные ионы, называемые катионами. Степень окисления металла определяется числовым значением, которое указывает, сколько электронов металл отдал иону или группе атомов. Например, медь всегда имеет степень окисления +2 или +1, а железо может иметь степень окисления +2 или +3, но никогда другую.
Постоянная степень окисления у металлов связана с электронной структурой и их расположением в периодической таблице элементов. Она определяется количеством электронов в валентной оболочке металла и его тенденцией отдавать или принимать электроны. Наличие постоянной степени окисления упрощает химический анализ и предсказывание реакций, связанных с металлами.
Окисление металлов: постоянная степень

Окисление металлов является важным процессом, который может происходить при взаимодействии металла с кислородом или другими окислителями. При этом образуются оксиды металлов, которые имеют определенную степень окисления. Стоит отметить, что у металлов степень окисления может быть постоянной.
Степень окисления металлов зависит от их валентности, то есть количества электронов, которые они могут отдать или принять при образовании химических связей. У различных металлов валентность может быть разной, но она сохраняется постоянной для каждого конкретного металла в рамках определенных условий
Например, у кислорода степень окисления всегда равна -2, а значит, для образования стабильного соединения с кислородом, металл должен иметь валентность равную положительному значению, противоположному значению степени окисления кислорода. Так, например, для образования оксида железа с формулой Fe2O3 степень окисления железа равна +3, так как его валентность равна +3.
Важно отметить, что химические свойства металлов, в том числе и окисление, определяются их внутренней структурой и электронной конфигурацией. Эти свойства металлов позволяют им образовывать стабильные соединения и сохранять постоянную степень окисления.
Степень окисления у металлов: что это?

Степень окисления – это числовое значение, которое показывает, сколько электронов металл отдал или принял в процессе химической реакции. Одна и та же металлическая платиновая основа может иметь различную степень окисления в разных соединениях.
Степень окисления у металлов является важным показателем и влияет на их химические свойства. Степень окисления можно определить по формуле соединения или по таблице степеней окисления. Например, для железа значение степени окисления может быть +2 или +3.
Степень окисления у металлов может быть также отрицательной. Например, в некоторых соединениях алюминия его степень окисления равна -3. Это происходит, когда металл принимает лишние электроны, образуя отрицательный ион.
Степень окисления у металлов может меняться при взаимодействии с другими веществами. Например, железо может окисляться или восстанавливаться в зависимости от условий реакции. Это явление используется в различных процессах, таких как ржавление или производство стали.
Знание степени окисления у металлов позволяет более точно предсказывать их реакционную способность и химическое поведение. Это важно для понимания и изучения различных химических процессов и применений металлов в различных областях науки и техники.
Универсальная постоянность степени окисления металлов
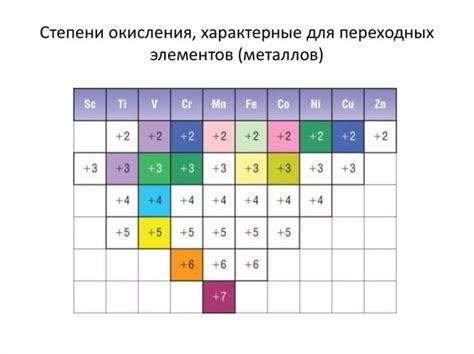
Степень окисления металлов является одной из основных характеристик химических элементов и обычно всегда постоянна. Каждый металл имеет свою собственную и уникальную степень окисления, которая определяется его электронной конфигурацией и внешней оболочкой. Хотя некоторые металлы могут иметь более одной степени окисления, эти значения являются строго определенными и неизменными для каждого элемента.
Принцип универсальной постоянности степени окисления металлов является одним из основных правил химии и широко применяется в различных химических реакциях и вычислениях. Это правило позволяет предсказывать и учитывать ионообменные реакции, соединения и синтез веществ.
Особенность металлов заключается в том, что они имеют тенденцию отдавать электроны и образовывать ионы положительных зарядов. Степень окисления металла определяется количеством электронов, которые он отдает при образовании своего иона. Например, железо (Fe) может иметь степень окисления +2 или +3, что означает, что оно может отстать 2 или 3 электрона.
- Степень окисления металлов влияет на их химические свойства, реактивность и способность принимать участие в химических реакциях.
- Знание степени окисления металла важно при составлении химических уравнений и расчете мольных соотношений в химических реакциях.
- Степень окисления металлов также может быть использована для определения количества вещества в растворах и проведения анализа вещества.
Универсальная постоянность степени окисления металлов обусловлена их электронной структурой и особенностями взаимодействия с другими элементами. Это правило помогает установить ясные и строгие рамки для изучения и понимания свойств и поведения металлов в химических процессах.
Исключения из правил: металлы с изменчивой степенью окисления
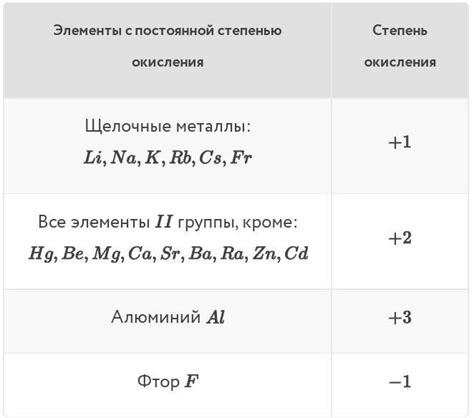
Степень окисления – это числовое значение, которое обозначает количество электронов, переданных атомом при образовании соединения. Однако, не все металлы имеют постоянную степень окисления. Некоторые из них, известные как металлы с изменчивой степенью окисления, могут образовывать соединения с разными степенями окисления одного и того же элемента.
Основные представители металлов с изменчивой степенью окисления:
- Железо (Fe): в соединениях может иметь степени окисления +2 или +3. Например, FeCl2 (хлорид железа(II)) и FeCl3 (хлорид железа(III)).
- Медь (Cu): может иметь степени окисления +1 или +2. Например, CuCl (хлорид меди(I)) и CuCl2 (хлорид меди(II)).
- Марганец (Mn): может иметь степени окисления +2, +3, +4, +6 или +7. Например, MnO2 (диоксид марганца) и KMnO4 (калий марганат(VII)).
- Свинец (Pb): встречается в соединениях с разными степенями окисления, включая +2, +4 и +6. Например, PbO (оксид свинца(II)) и PbO2 (оксид свинца(IV)).
Причины изменчивости степени окисления:
Изменчивость степени окисления металлов обусловлена их способностью принимать и отдавать разное количество электронов при образовании соединений. Это связано с энергетическими особенностями электронных оболочек атомов металлов и их взаимодействием с другими частицами. Некоторые металлы имеют различные окислительные состояния, что позволяет им образовывать более широкий спектр соединений с разными функциями и свойствами.
Значение для практики:
Знание об изменчивости степени окисления металлов имеет большое значение в химической промышленности и лабораторной практике. Металлы с изменчивой степенью окисления широко используются для получения искусственных соединений, катализаторов, пигментов и многих других продуктов, которые находят применение в различных отраслях промышленности и научных исследованиях.
Комплексное состояние металлов и их окисление
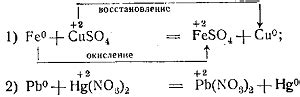
Окисление – это процесс, при котором вещество или атом теряет электроны. В контексте металлов это означает, что они могут переходить в состояние с увеличенной степенью окисления. Стоит отметить, что степень окисления металлов не всегда постоянна и может изменяться в зависимости от условий.
Металлы обладают уникальными свойствами и способностью образовывать специфические комплексы с различными соединениями, включая кислородные соединения. Это означает, что металлы могут образовывать различные оксиды, супероксиды, пероксиды и другие окислительные соединения.
Некоторые металлы, такие как железо и алюминий, могут образовывать оксиды различной степени окисления. Например, у железа существуют оксиды FeO, Fe₂O₃ и Fe₃O₄, где железо может быть в разных степенях окисления. Аналогично, у алюминия есть оксиды Al₂O₃ и AlO, где степень окисления алюминия также отличается.
Другим примером является свинец, который может образовывать оксиды с различными степенями окисления: PbO, PbO₂ и Pb₃O₄. Это свидетельствует о том, что металлы могут иметь несколько вариантов окисления и формировать соединения с разной степенью окисления.
Таким образом, можно сказать, что металлы могут находиться в различных комплексных состояниях и образовывать соединения с меняющейся степенью окисления. Именно это позволяет им проявлять разнообразные свойства и использоваться в различных областях науки и техники.
Влияние физических факторов на степень окисления

Степень окисления металлов может изменяться под воздействием различных физических факторов, таких как температура, давление, свет и электрическое поле.
Одним из факторов, влияющих на степень окисления металлов, является температура. При повышении температуры металлы могут вступать в реакцию с кислородом сильнее, что приводит к увеличению их степени окисления. Например, железо при нагревании в воздухе окисляется и превращается в ржавчину.
Давление является еще одним фактором, который влияет на степень окисления металлов. Под действием высокого давления металлы могут претерпевать структурные изменения, что в свою очередь может приводить к изменению их степени окисления. Например, некоторые металлы при высоком давлении могут образовывать соединения с более высокой степенью окисления.
Свет также может оказывать влияние на степень окисления металлов. Некоторые металлы обладают фотокаталитическими свойствами, то есть они могут вступать в реакцию с кислородом под воздействием света. Это может привести к изменению степени окисления металла и образованию новых соединений.
Наконец, электрическое поле также может влиять на степень окисления металлов. Под действием электрического поля металлы могут образовывать электронные переносчики, что может способствовать окислению или восстановлению металлов. Это может привести к изменению степени окисления и образованию различных соединений.
Значение степени окисления металлов в химических реакциях

Степень окисления металлов играет важную роль в химических реакциях, так как определяет их характер и результаты. Степень окисления металлов - это формальный заряд металла, который показывает, сколько электронов металл отдал или принял.
Степень окисления металлов может быть положительной, отрицательной или нулевой. Положительная степень окисления означает, что металл отдал электроны и окислился. Отрицательная степень окисления означает, что металл принял электроны и обратился в ион. Нулевая степень окисления означает, что металл не окислился и электроны не перешли.
Степень окисления металлов в химических реакциях можно определить, зная состав соединения и заряд других ионов. Например, в соединениях с полиатомными ионами, степень окисления металла может быть определена по его заряду, который указан на ионе. В случае монатомных ионов или атомов, степень окисления металла может быть определена по общему заряду соединения или при помощи балансировки уравнения реакции.
Значение степени окисления металлов в химических реакциях влияет на характер и направление реакции. Металлы с более высокой степенью окисления могут проявлять сильные окислительные свойства и реагировать с веществами, которые могут отдать электроны. Металлы с более низкой степенью окисления могут проявлять сильные восстановительные свойства и реагировать с веществами, которые могут принять электроны. В то же время, степень окисления металла также может влиять на его способность образовывать соединения с другими элементами и соединениями.
Современные методы определения степени окисления металлов

Степень окисления металлов - это важный параметр, характеризующий изменение валентности атомов металла при образовании соединений. Определение степени окисления металлов является важной задачей для многих областей науки и промышленности, таких как химия, физика и материаловедение.
Современные методы определения степени окисления металлов включают использование различных инструментов и аналитических методов. Один из таких методов - использование химических реакций и определение продуктов этих реакций с помощью различных методов анализа, включая спектроскопию и хроматографию.
Другим методом является использование электрохимических методов, таких как вольтамперометрия и потенциостатический анализ. Эти методы основаны на измерении потенциала и тока, возникающих при окислительно-восстановительных реакциях металлов.
Также существуют методы определения степени окисления металлов с использованием компьютерного моделирования и симуляций. Эти методы позволяют предсказать степень окисления металлов на основе известных физических, химических и электрохимических свойств соединений.
В целом, современные методы определения степени окисления металлов предоставляют удобные и точные инструменты для анализа и изучения металлических соединений. Они позволяют исследователям и инженерам более глубоко понять свойства и поведение металлов, а также применить эту информацию в различных прикладных областях.
Вопрос-ответ

Почему у металлов степень окисления всегда постоянна?
Степень окисления металлов зависит от их электрохимической активности и способности отдавать или принимать электроны. У металлов существует определенный диапазон степеней окисления, в пределах которого они могут образовывать соединения. Это связано с их электронной конфигурацией и количеством свободных электронов в внешней оболочке.
Какие факторы влияют на степень окисления металлов?
Степень окисления металлов устанавливается на основе различных факторов, включая давление, температуру, pH среду и наличие других реагентов. Данные факторы могут изменять способность металлов отдавать или принимать электроны, и, следовательно, их степень окисления.
Существуют ли исключения, когда степень окисления металлов не постоянна?
Да, существуют исключения, когда степень окисления металлов может изменяться. Например, некоторые металлы, такие как железо или медь, могут иметь несколько степеней окисления в различных соединениях. Это связано с тем, что эти металлы могут образовывать соединения с разными количествами электронов-акцепторов.
