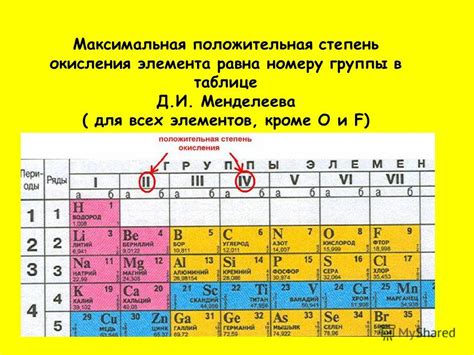
Степень окисления – это числовое значение, которое показывает число неравноценностей между атомами элемента в соединении. Важно отметить, что степень окисления металлов всегда положительна, и это обусловлено их физическими и химическими свойствами.
В основе такого свойства лежит строение атома металла и его электронная конфигурация. Атом металла имеет достаточно маленький радиус и относительно большое количество электронов. За счет этого, внешние электроны металла слабо притягиваются к ядру, что позволяет им легко участвовать в химических реакциях. В результате металлы образуют ионы с положительными зарядами.
Еще одна причина положительной степени окисления металлов – высокая электроотрицательность неметаллов. Во время образования химической связи между металлом и неметаллом, неметалл привлекает к себе общие электроны, создавая полярную химическую связь. Это приводит к образованию иона металла с положительным зарядом.
Также степень окисления металлов может быть определена их позицией в периодической системе химических элементов. Металлы, находящиеся слева от середины периодической системы, обычно имеют одну и ту же степень окисления, например, валентность +2 или +3. Это объясняется тем, что металлы в данной области имеют одинаковую электронную конфигурацию в своих валентных оболочках и способны терять определенное количество электронов.
Таким образом, положительная степень окисления металлов связана как с особенностями их атомов и электронной конфигурацией, так и с химическим взаимодействием металлов с неметаллами.
Причины положительной степени окисления у металлов
Степень окисления или валентность металлов представляет собой число, которое отражает способность атома данного металла отдавать или принимать электроны при образовании химических связей. Положительная степень окисления у металлов является результатом следующих факторов:
- Металлы обладают малым электроотрицательностью, что обусловливает их склонность отдавать электроны и образовывать положительные ионы. Электроотрицательность характеризует способность атома притягивать к себе электроны во время химической реакции.
- Металлы имеют низкую энергию ионизации, что означает, что имеющиеся у них электроны слабо привязаны и могут легко отделяться от атома. Энергия ионизации представляет собой энергию, необходимую для отделения электрона от атома и образования положительного иона.
- Металлы обладают большими атомами и малой электронной оболочкой. Большие атомы имеют большую вероятность отдать электроны и образовать положительные ионы, так как их электронная плотность находится дальше от ядра и слабо притягивается к нему.
В результате, металлы, обладающие данными свойствами, способны образовывать положительные ионы и иметь положительную степень окисления в химических соединениях. Это может служить основой для понимания и изучения реакций, свойств и синтеза различных соединений, а также применения металлов в различных областях науки и техники.
Электроотрицательность веществ
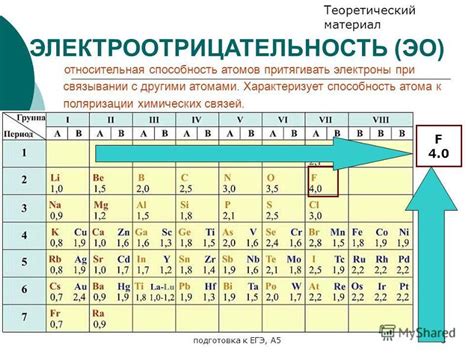
Электроотрицательность – это способность атома притягивать к себе электроны в химической связи. Она характеризует разность в электронегативности двух атомов, участвующих в образовании связи. Чем выше электроотрицательность атома, тем сильнее он притягивает электроны к себе.
Таблица электроотрицательностей Мюллера-Полинга позволяет сравнивать электроотрицательности различных веществ. Периодическая система элементов отражает изменение электроотрицательности веществ по группам и периодам.
Наиболее электроотрицательны вещества из группы галогенов и кислородсодержащие соединения, такие как азот, сера и фосфор. Эти элементы с легкостью притягивают электроны и образуют отрицательные ионы. Металлы, напротив, имеют меньшую электроотрицательность, что позволяет им легче отдавать электроны при образовании химических связей.
Различие в электроотрицательности атомов вещества определяет его химические свойства, такие как реакционная способность, способность к образованию ионов и соединений. Электроотрицательность также играет важную роль в определении степени окисления металлов. Металлы обычно имеют положительное значение степени окисления, так как они образуют ионы, отдавая электроны.
Процесс окисления и реакции с кислородом

Окисление – это процесс химической реакции, в результате которой происходит потеря электронов. Основной активным окислителем во многих реакциях является кислород.
Реакции с кислородом происходят между металлами и кислородом и являются типичными окислительно-восстановительными реакциями. В таких реакциях металлы образуют оксиды, при этом степень окисления металлов всегда положительна.
Когда металл взаимодействует с кислородом, он теряет электроны и становится положительно заряженным, так как электроны передаются кислороду. Кислород, в свою очередь, получает электроны и становится отрицательно заряженным. Результатом такой реакции является образование оксида металла.
Степень окисления металлов всегда положительна, потому что металлы склонны отдавать электроны и образовывать положительные ионы в реакциях с кислородом. Такая тенденция обусловлена их электронной структурой – у металлов на внешнем энергетическом уровне находятся малое количество электронов, что делает их легкими проигрывателями в таких реакциях.
Строение атомов металлов
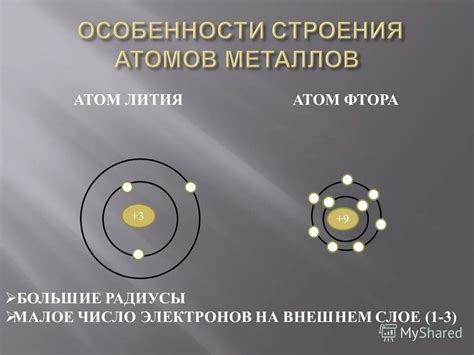
Атомы металлов являются основными строительными блоками металлических материалов. Они состоят из ядра, окруженного облаком электронов. Ядро атома содержит протоны и нейтроны, имеющие положительные и нейтральные заряды соответственно. Облако электронов, в свою очередь, состоит из электронов, которые обладают отрицательным зарядом.
Строение атомов металлов имеет свою особенность - у металлов внешний энергетический уровень (валентный энергетический уровень) состоит из незаполненных электронов. Это позволяет металлам легко отдавать и принимать электроны и образовывать ионы с положительным зарядом, что и определяет степень окисления металлов, всегда положительную.
Строение атомов металлов также обуславливает их способность образовывать металлическую связь, которая основана на обмене электронами между атомами. В металлах облако электронов образует "море свободных электронов", которые свободно движутся по кристаллической решетке и обеспечивают прочность и электрическую проводимость металлов.
Строение атомов металлов можно сравнить с постройкой крепкого замка - ядро атома - это каменные стены, окружающие облако электронов. Валентный энергетический уровень атомов металлов - это наружная область замка, где происходят взаимодействия с другими атомами. Подобно тому, как открытие замка требует отдельный ключ, перемещение электронов между атомами металлов требует определенных энергетических условий.
Тенденция ктонантоксидации
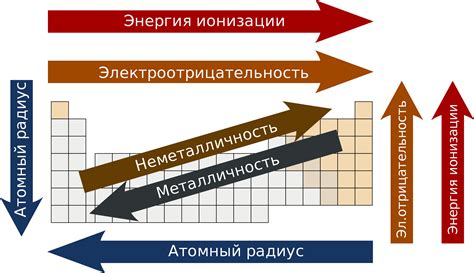
Степень окисления металлов всегда положительна из-за их способности образовывать ионные соединения с неположительно заряженными атомами или группами. Такая тенденция, называемая катионоксидацией, определяет химическую активность металлов и их способность вступать в реакции окисления.
Катионоксидация является основным механизмом, посредством которого металлы реагируют с кислотами и образуют ионы металла в положительной степени окисления. Это происходит за счет потери электронов металлом, чтобы компенсировать отрицательный заряд атома или группы, с которыми он реагирует.
Тенденция к катионоксидации обусловлена строением атомов металлов и энергетическими характеристиками истощенной энергетической оболочки. Атомы металлов, находящиеся в главной группе периодической системы, имеют внешнюю энергетическую оболочку, содержащую незанятые d- или f-орбитали. В процессе катионоксидации электроны из этих орбиталей могут быть переданы атомам или группам с более высокими значениями отрицательной энергии и, следовательно, более высокими значениями электроотрицательности.
Основной причиной, по которой степень окисления металлов всегда положительна, является стремление металлов к достижению более стабильного электронного состояния. Путем потери электронов они становятся положительно заряженными ионами, что позволяет им образовывать стабильные соединения с отрицательно заряженными атомами или группами. Это устойчивое состояние является энергетически более выгодным для металлов и обеспечивает им химическую активность и способность к реакциям окисления.
Вопрос-ответ

Почему степень окисления металлов всегда положительна?
Степень окисления металлов всегда положительна, потому что они имеют свободные электроны в своей внешней оболочке. Когда металл вступает в химическую реакцию с другим веществом, электроны от металла переходят на другое вещество, создавая положительный заряд на металле.
Почему металлы имеют свободные электроны в своей внешней оболочке?
Металлы имеют свободные электроны в своей внешней оболочке из-за особенностей их строения. У металлов внешняя оболочка обычно состоит из нескольких энергетических уровней, и она может содержать больше электронов, чем наполнено электронами. Из-за этого некоторые электроны оказываются несвязанными с атомом и могут свободно двигаться по металлу.
Какие последствия имеет положительная степень окисления у металлов?
Положительная степень окисления у металлов означает, что они склонны отдавать электроны другим веществам при химической реакции. Это делает металлы хорошими восстановителями, способными уменьшать степень окисления других веществ. Кроме того, положительная степень окисления металлов позволяет им образовывать ионы, которые легко реагируют с отрицательно заряженными частицами, такими как анионы, и образуют соли и соединения.
Есть ли исключения, когда степень окисления металлов может быть отрицательной?
Обычно степень окисления металлов положительна, но есть несколько исключений. Некоторые металлы, такие как марганец или хром, могут иметь разные степени окисления, включая и отрицательные. Отрицательная степень окисления указывает на то, что металл получил дополнительные электроны и стал анионом в составе соединения.
