В химии степень окисления металлов является важным понятием, определяющим их химические свойства и способность образовывать соединения с другими элементами. Степень окисления показывает число электронов, переданных металлом при образовании химической связи. Это значение может быть положительным, отрицательным или нулевым.
Некоторые известные примеры металлов с положительной степенью окисления включают такие элементы, как железо, алюминий, медь и цинк. Железо, например, может иметь степень окисления +2 или +3 в различных соединениях. Алюминий, с другой стороны, образует только соединения с положительным значением, как правило, +3.
Однако некоторые металлы могут иметь отрицательную степень окисления. К таким металлам относятся, например, марганец и хром. Марганец может иметь степень окисления -2 или -3, в то время как хром может иметь степень окисления от -2 до +6 в зависимости от соединения.
Нулевая степень окисления свойственна элементарным металлам, которые не образуют ионы. Однако некоторые элементы способны иметь переменное значение окисления и образовывать ионы с разными степенями окисления. Это позволяет им образовывать богатый набор соединений и проявлять различные химические свойства.
Понимание степени окисления металлов является важным для понимания их роли в химических реакциях, а также для предсказания их способности образовывать соединения и взаимодействовать с другими элементами. Изучение конкретных примеров и разнообразия степеней окисления металлов позволяет получить более полное представление о химическом мире.
Степень окисления металлов: основные примеры
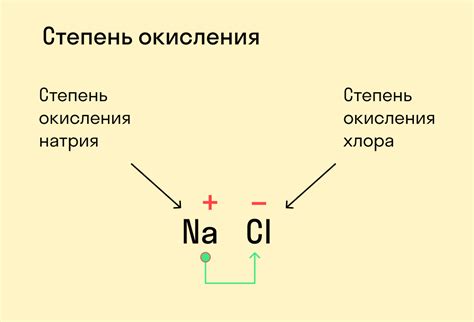
Степень окисления металла - это число, которое указывает на количество электронов, переданных атомом металла во время окислительно-восстановительных реакций. Степень окисления может быть положительной, отрицательной или нулевой.
В таблице Менделеева есть несколько металлов, у которых часто встречаются определенные значения степени окисления. Рассмотрим некоторые примеры:
- Железо (Fe) - часто встречается в степенях окисления +2 и +3. Например, соединение Fe2O3, известное как ржавчина, содержит железо с +3 степенью окисления.
- Медь (Cu) - обычно имеет степень окисления +1 и +2. Например, соединение CuCl2 содержит медь с +2 степенью окисления.
- Свинец (Pb) - может иметь степени окисления +2 и +4. Например, соединение PbO2 содержит свинец с +4 степенью окисления.
Также степень окисления металлов может быть варьирующейся. Например, у железа основная степень окисления +2, однако оно также может иметь степень окисления +4 в некоторых соединениях.
Степень окисления металлов играет важную роль в химических реакциях и определяет их свойства. Знание основных примеров степени окисления металлов помогает понять и объяснить множество химических процессов.
Понятие степени окисления
Степень окисления – это числовое значение, которое указывает на то, сколько электронов металл отдал или принял при образовании соединения. Степень окисления является основным показателем для определения химической активности металла и его способности вступать в реакции с другими веществами.
Каждый металл в соединении может иметь определенную степень окисления, которая определяется в соответствии с определенными правилами. Одним из ключевых правил является правило о том, что общая степень окисления всех элементов в соединении должна быть равна нулю или равна заряду самого соединения.
Степень окисления может быть положительной, отрицательной или нулевой. Положительная степень окисления указывает на то, что металл отдал электроны, а отрицательная - на то, что металл принял электроны. Нулевая степень окисления характерна для атомов металла в элементарном состоянии, когда он не образует соединения.
Активные металлы: примеры и свойства

Активные металлы - это элементы, которые легко вступают в химические реакции с другими веществами. Они обладают высокой реакционной способностью и обычно имеют положительную степень окисления.
Одним из примеров активного металла является натрий (Na). Он является очень реакционным элементом и легко реагирует с кислородом воздуха, образуя оксид натрия (Na2O). Натрий также реагирует с водой, образуя гидроксид натрия (NaOH) и выделяяся водород (H2).
Другим примером является калий (K). Он также является активным металлом и реагирует с водой, образуя гидроксид калия (KOH) и выделяя водород (H2). Калий также вступает в реакцию с кислородом воздуха, образуя оксид калия (K2O).
Активные металлы обычно имеют мягкую текстуру и низкую температуру плавления и кипения. Они хорошо проводят тепло и электричество. Важными свойствами активных металлов являются их реакционная способность и способность образовывать ионы положительного заряда (катионы).
Переходные металлы: особенности окисления
Переходные металлы - это элементы, которые находятся в середине периодической таблицы и имеют переменные степени окисления. Они обладают особыми химическими свойствами, которые определяются наличием наружных d-электронных оболочек.
В отличие от элементов с фиксированной степенью окисления, у переходных металлов эта степень может варьироваться в зависимости от условий реакции. Это связано с возможностью переноса электронов между различными d-орбиталями.
Окисление переходных металлов может протекать по разным сценариям, в зависимости от их электронной конфигурации. Например, металлы первой половины периодической системы (такие, как железо, кобальт, марганец) имеют тенденцию к потере двух или трех электронов при образовании положительных ионов.
В то же время, металлы второй половины периодической системы (такие, как медь, серебро, золото) имеют тенденцию к потере одного или двух электронов. Однако, у некоторых из них могут быть и другие степени окисления, например, Cu+ и Cu2+ у меди.
Кроме того, окисление переходных металлов может быть связано с образованием комплексных соединений с различными лигандами. Это позволяет им образовывать различные структуры и принимать разные степени окисления в зависимости от природы лиганда.
Таким образом, окисление переходных металлов имеет свои особенности, связанные с их электронной конфигурацией и возможностью образования комплексных соединений. Это делает их особо интересными объектами изучения в химии.
Окислительные и восстановительные свойства металлов

Металлы - это элементы, обладающие отличными окислительными и восстановительными свойствами. Окисление и восстановление - это процессы, связанные с передачей электронов между атомами или ионами в химической реакции.
Металлы, как правило, обладают выраженной склонностью к окислению. Они легко отдают электроны, становясь положительно заряженными ионами - катионами. Это свойство делает металлы хорошими восстановителями. Они способны передавать электроны другим веществам, проявляя свои химические свойства. Например, железо может восстановить кислород из воды, образуя ржавчину.
Окислительные свойства металлов проявляются, когда они вступают в реакцию с не металлами, такими как кислород или сера. В результате окисления металлы образуют окислы - соединения, в которых они находятся в положительном окислительном состоянии. Это чаще всего проявляется в формировании оксидов, которые являются одним из самых распространенных классов окислов металлов.
Восстановительные свойства металлов проявляются, когда они передают свои электроны окислителю - веществу, способному принять электроны. При этом металл сам становится окисленным. Восстановительными металлами являются, например, цинк и магний. Они способны восстановить ионы металлов в растворе или соединениях, восстанавливая их положительное окислительное состояние.
Окислительные и восстановительные свойства металлов широко используются в различных процессах, включая гальваническую коррозию, электролиз, химический синтез и другие. Изучение этих свойств металлов позволяет лучше понять их поведение в химических реакциях и применить их в различных областях науки и техники.
Вопрос-ответ

Как определить степень окисления металлов?
Степень окисления металлов можно определить по заряду, который имеет их ион в соединении. Заряд иона равен степени окисления металла в данном соединении. Например, для катиона железа Fe3+ степень окисления равна +3.
Какие металлы могут образовывать ионы с положительной степенью окисления?
Металлы, которые наиболее часто образуют ионы с положительной степенью окисления, включают металлы из группы 1 и 2 периодической системы (например, литий, натрий, калий, магний, кальций) и некоторые металлы из группы 3 (например, алюминий, железо, хром).
