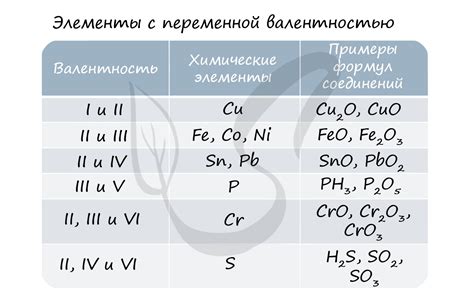
Степень окисления металла является важным параметром для определения его химической активности и способности взаимодействовать с другими веществами. Третья степень окисления является одной из возможных степеней окисления металла и имеет свои особенности и свойства.
Когда металл имеет третью степень окисления, это означает, что он потерял три электрона. Третья степень окисления также может быть обозначена как "+3". Это означает, что у металла есть три свободных электрона, которые могут участвовать в химических реакциях. Такие металлы обычно обладают высокой химической активностью и могут образовывать соединения с другими элементами.
Степень окисления металла может быть определена различными способами, включая анализ химических свойств и реакций, изучение электронной структуры металла и использование специальных методов и приборов. Знание степени окисления металла может быть полезно для понимания его реактивности, использования в различных промышленных процессах и создания новых материалов и соединений.
Что такое степень окисления
Степень окисления – это числовое значение, которое отражает изменение электронного состояния атома металла при образовании химической связи с другими элементами. В химических соединениях металл может передавать или принимать электроны, изменяя свою степень окисления.
Степень окисления измеряется величиной, равной числу электронов, потерянных или полученных атомом металла. Если металл отдает электроны, его степень окисления считается положительной. Если металл принимает электроны, его степень окисления считается отрицательной. Ноль обозначает степень окисления элемента во веществе в атомном состоянии.
Степень окисления металла играет важную роль при определении его химических свойств и возможности образования соединений с другими веществами. Она определяет способность металла к окислению или восстановлению, а также его активность и химическую реактивность.
Важно отметить, что степень окисления может изменяться в различных химических соединениях металла. Некоторые металлы имеют несколько степеней окисления, что позволяет им образовывать разнообразные соединения и проявлять свои химические свойства в различных условиях.
Как определить третью степень окисления
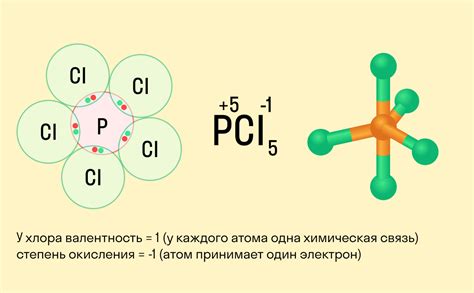
Третья степень окисления металла является одной из основных характеристик, определяющих его химическую активность и способность принимать или отдавать электроны при реакциях окисления-восстановления. Определение третьей степени окисления металла может быть полезным при изучении его свойств и химических реакций.
Есть несколько способов определить третью степень окисления металла. Один из них - это анализ химической формулы соединения, в котором содержится данный металл. В формуле каждый атом металла обладает определенной степенью окисления, которую можно установить, изучая его возможные комбинации с другими элементами. Третья степень окисления обычно указывается в римской цифре III.
Еще один способ определения третьей степени окисления - это анализ реакций, в которых участвует данный металл. Третья степень окисления обычно связана с потерей трех электронов при окислительной реакции. Если металл принимает участие в реакции, где происходит переход электронов со степенью окисления +3, то это говорит о третьей степени окисления металла.
Определение третьей степени окисления металла имеет важное значение для понимания его химической активности и реакционной способности. Знание степени окисления металла позволяет предсказывать его поведение в различных химических реакциях и использовать его в синтезе соединений или получении новых материалов с определенными свойствами.
Свойства металлов в третьей степени окисления

Степень окисления металла — это электрический заряд, приобретаемый металлом во время окисления. Металлы в третьей степени окисления имеют особые свойства, которые определяют их поведение и применение.
Металлы в третьей степени окисления обладают высокой реактивностью и активной химической активностью. Они способны образовывать различные окислы и соли, а также проявлять окислительные свойства.
Одним из наиболее известных металлов в третьей степени окисления является олово (Sn). Оно обладает хорошей пластичностью и прочностью, что делает его идеальным материалом для производства различных изделий, включая покрытия, электроды, упаковочные материалы и прочие изделия.
Олово обладает также хорошей кондуктивностью и является хорошим проводником электричества. Благодаря этому свойству олово широко используется в электронике, в производстве микросхем, печатных плат и других электронных компонентов.
Кроме олова, в третьей степени окисления также находится хром (Cr). Хром обладает высокой коррозионной стойкостью и устойчив к механическим воздействиям, что делает его идеальным материалом для производства сопротивляющихся коррозии и прочих специализированных изделий.
Хром используется в различных областях промышленности, включая автомобильную, строительную и электротехническую отрасли. Он также нашел применение в медицине и стоматологии, благодаря своей антибактериальной активности и возможности использования в имплантатах.
Металлы в третьей степени окисления представляют собой важную группу в периодической системе элементов. Их свойства и возможности использования делают их весьма ценными и востребованными материалами в различных отраслях промышленности и науке.
Примеры металлов с третьей степенью окисления
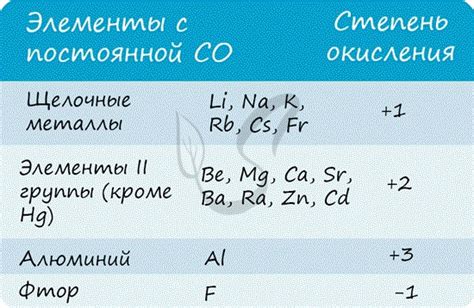
Степень окисления металла определяет количество электронов, которые металл отдал или получил при образовании соединения с другими веществами. Металлы могут иметь различные степени окисления, включая третью степень окисления.
Один из примеров металлов с третьей степенью окисления - это алюминий (Al). В соединении оксида алюминия (Al2O3), алюминий имеет степень окисления +3. Этот оксид широко используется в промышленности в качестве компонента для производства алюминия и его сплавов.
Другим примером металла с третьей степенью окисления является хром (Cr). В соединении оксида хрома (Cr2O3), хром имеет степень окисления +3. Это соединение используется в производстве красок, керамики и некоторых стеклянных изделий.
Также можно отметить железо (Fe) с третьей степенью окисления. В соединении оксида железа (Fe2O3), железо имеет степень окисления +3. Оксид железа известен своей красной окраской и широко используется в производстве красок, пигментов и катализаторов.
В таблице металлов с третьей степенью окисления также можно найти металлы, такие как кобальт (Co), марганец (Mn) и их соединения с кислородом, имеющие степень окисления +3. Эти металлы играют важную роль в различных отраслях промышленности, включая производство сплавов, батареек и магнитов.
Реакции металлов с третьей степенью окисления

Металлы с третьей степенью окисления обладают высокой активностью и способны участвовать в различных химических реакциях. Третья степень окисления характеризуется потерей трех электронов металлом.
Одной из типичных реакций металлов с третьей степенью окисления является их взаимодействие с галогенами. Металлы такой группы, как железо, алюминий или хром, могут быть окислены хлором, бромом или йодом, образуя соответствующие соли. Например, реакция алюминия с хлором приводит к образованию хлорида алюминия (AlCl3).
Другими распространенными реакциями являются окислительные реакции металлов с третьей степенью окисления. Например, окисление железа (III) оксидом кислорода (O2) приводит к образованию оксида железа (III) (Fe2O3). Подобные реакции широко используются в промышленности и находят применение при производстве различных металлических соединений и сплавов.
Гидролиз металлов с третьей степенью окисления представляет еще одну интересную группу реакций. Например, гидролиз оксида алюминия (Al2O3) позволяет получить алюминиевую кислоту (Al(OH)3). Такие реакции играют важную роль в химической промышленности и используются при получении различных продуктов на основе данных металлов.
Применение металлов с третьей степенью окисления

Металлы с третьей степенью окисления являются важными компонентами различных промышленных процессов и приложений. Данные металлы обладают уникальными свойствами и широко используются в разных отраслях промышленности.
Один из самых распространенных металлов с третьей степенью окисления - алюминий. Он широко применяется в авиационной и автомобильной промышленности благодаря своей низкой плотности и высокой прочности. Алюминий также используется в производстве конденсаторов, упаковочных материалов и электродов для сварки.
Вторым примером металла с третьей степенью окисления является хром. Хром широко применяется в металлургии, производстве нержавеющей стали и других сплавов. Он также используется в химической промышленности для производства пигментов и катализаторов. Благодаря своей стойкости к коррозии, хром также используется в отделке и декоративной промышленности.
Еще одним важным примером металла с третьей степенью окисления является железо. Железо широко используется в строительстве, машиностроении и других отраслях промышленности. Оно является основным компонентом стали и сплавов с высокой прочностью. Железо также используется в производстве электромагнитов, трансформаторов и других электронных устройств.
Таким образом, металлы с третьей степенью окисления имеют широкий спектр применения и оказывают значительное влияние на различные отрасли промышленности. Их уникальные свойства и химическая активность делают их неотъемлемыми компонентами множества процессов и продуктов, которые мы используем ежедневно.
Вопрос-ответ

Как определить третью степень окисления металла?
Определить третью степень окисления металла можно по анализу электронной формулы вещества. Если металл имеет третью степень окисления, то число электронов, которые он отдал, будет равно модулю этой степени окисления.
Какие примеры можно привести третьей степени окисления металлов?
Примерами металлов с третьей степенью окисления могут служить железо (Fe^3+), алюминий (Al^3+), хром (Cr^3+), марганец (Mn^3+) и др. При взаимодействии этих металлов с другими элементами они способны отдать три электрона.
Какая роль играет третья степень окисления металла в реакциях?
Третья степень окисления металла играет важную роль в реакциях, так как она указывает на количество электронов, которые металл может отдать другим веществам. Это позволяет предсказать тип реакций, в которых может участвовать данный металл.
