Стандартные электродные потенциалы не металлов - это важные характеристики, которые определяют их способность участвовать в электрохимических реакциях. Они отражают способность атома или иона не металла отдавать или принимать электроны при образовании соответствующего оксидационного или восстановительного состояния.
Стандартные электродные потенциалы не металлов измеряются относительно водорода, которому приписывается произвольный электродный потенциал 0 В. Положительные значения стандартных электродных потенциалов указывают на то, что не металл способен окисляться, т.е. отдавать электроны, а отрицательные значения - наоборот, указывают на то, что не металл имеет большую афинность к электронам и предпочитает принимать их.
Определение стандартных электродных потенциалов не металлов позволяет понять и объяснить многие электрохимические процессы, такие как коррозия металлов, гальванические элементы и электролиз. Кроме того, стандартные электродные потенциалы необходимы для расчета электродного потенциала гальванической ячейки и определения возможности протекания электрохимической реакции.
Что такое стандартные электродные потенциалы?

Стандартные электродные потенциалы – это электродные потенциалы полу-реакций, связанных с окислением или восстановлением вещества, которые измеряют относительную силу окислительного или восстановительного действия.
Стандартные электродные потенциалы обозначаются как E° и измеряются в вольтах. Они рассчитываются при определенных стандартных условиях, включающих температуру 25 °C, давление 1 атмосфера и концентрацию ионов 1 Моль/л.
Электродные потенциалы характеризуют способность вещества принимать или отдавать электроны. Они используются для определения направления и силы химических реакций. Если электродный потенциал больше нуля, значит вещество имеет окислительные свойства и способно вступать в реакцию окисления. Если электродный потенциал меньше нуля, значит вещество имеет восстановительные свойства и способно вступать в реакцию восстановления.
Установление стандартных электродных потенциалов необходимо для определения последовательности металлов по их окислительной способности, а также для расчета электродных потенциалов сложных систем.
Значение стандартных электродных потенциалов
Стандартные электродные потенциалы являются важным показателем для определения способности вещества к окислительно-восстановительным реакциям. Они определяются относительно водородного электрода, которому присваивается произвольное значение 0 В.
Значение стандартного электродного потенциала может быть положительным или отрицательным и показывает, насколько вещество способно принять или отдать электроны в реакции окисления или восстановления.
Например, стандартный электродный потенциал цинка (Zn) равен -0,76 В, что означает, что цинк легко окисляется при взаимодействии с растворами, например, с раствором сульфата меди.
Сравнивая разные стандартные электродные потенциалы, можно определить направление и скорость электрохимической реакции. Если разность потенциалов положительна, то реакция протекает самопроизвольно в направлении, определенном положительным ионом. Если разность потенциалов отрицательна, реакция может проходить, но будет требоваться внешнее воздействие для перемещения электронов в нужном направлении.
Почему стандартные электродные потенциалы важны?
Стандартные электродные потенциалы являются важными величинами при изучении химических и электрохимических процессов. Они позволяют оценить степень активности и реакционную способность веществ, а также определить направление электрохимических реакций.
С помощью стандартных электродных потенциалов можно предсказать, какие вещества могут служить окислителями или восстановителями. Если электродный потенциал вещества положительный, то оно способно обладать окислительными свойствами, а если отрицательный - восстановительными.
Зная значения стандартных электродных потенциалов не металлов, можно определить относительную силу окислительных и восстановительных свойств различных веществ. Например, если наличие двух веществ с разными электродными потенциалами в растворе, то вещество с более положительным потенциалом будет окислять вещество с более отрицательным потенциалом.
Благодаря стандартным электродным потенциалам можно определить возможность проведения электрохимических реакций и выбрать наиболее эффективный способ получения электрической энергии. Также эти данные находят применение в различных областях науки и техники, таких как электрогальваника, аккумулятормы, электролиз и др.
Как определить стандартные электродные потенциалы?
Стандартные электродные потенциалы не металлов – это величины, которые позволяют оценить способность вещества принять или отдать электроны во время реакции окисления-восстановления. Они измеряются относительно электрода водорода, при котором его потенциал принимается равным нулю.
Существуют различные методы определения стандартных электродных потенциалов не металлов. Один из таких методов – измерение ЭДС гальванической ячейки, состоящей из исследуемого электрода и эталонного электрода. При этом измеряют разность потенциалов между исследуемым и эталонным электродами.
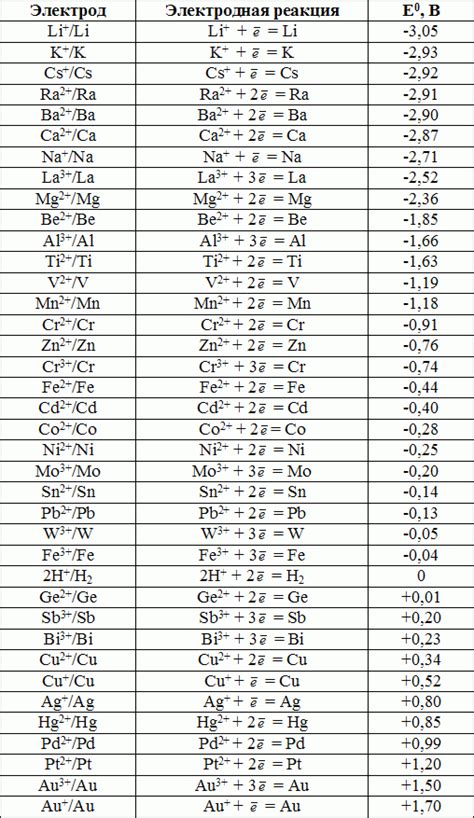
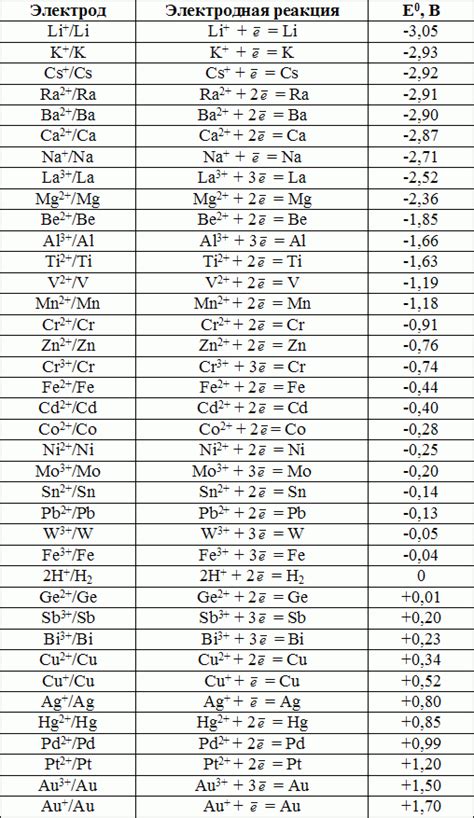
Также существует таблица стандартных электродных потенциалов, в которой собраны значения для различных элементов. Она позволяет определить потенциал исследуемого электрода относительно эталонного электрода и сравнить его с другими элементами.
Определение стандартных электродных потенциалов имеет важное значение для различных областей химии и электрохимии. Знание этих потенциалов позволяет предсказывать направление и интенсивность реакций окисления-восстановления, а также понимать основные принципы работы электрохимических устройств, таких как аккумуляторы и гальванические элементы.
Примеры стандартных электродных потенциалов

Стандартные электродные потенциалы не металлов позволяют оценить их способность выступать в качестве окислителя или восстановителя. Некоторые из примеров таких стандартных потенциалов:
- Кислород (O2): стандартный электродный потенциал равен 1.23 В. Это значит, что кислород может восстанавливаться до воды на электроде при напряжении 1.23 В.
- Вода (H2O): стандартный электродный потенциал равен 0 В. Это означает, что вода является эталоном для измерения других электродных потенциалов.
- Водород (H2): стандартный электродный потенциал равен 0 В. Водородное напряжение выступает в роли эталона и является нулевым.
- Хлор (Cl2): стандартный электродный потенциал равен 1.36 В. Хлор обладает большей способностью к окислению по сравнению с кислородом.
- Фтор (F2): стандартный электродный потенциал равен 2.87 В. Фтор обладает наибольшей способностью к окислению среди неметаллов.
Эти примеры демонстрируют, как различные неметаллы проявляют свою химическую активность на электродах в реакциях окисления и восстановления. Более полная таблица стандартных электродных потенциалов не металлов позволяет сравнивать их электрохимическую активность и предсказывать ход реакций.
Влияние стандартных электродных потенциалов на химические реакции

Стандартные электродные потенциалы могут оказывать значительное влияние на химические реакции. Они определяют направление и интенсивность процессов окисления и восстановления в химических системах. Каждый элемент имеет свой уникальный стандартный электродный потенциал, который характеризует его способность отдавать или принимать электроны.
Положительное значение стандартного электродного потенциала означает, что элемент способен окисляться, т.е. отдавать электроны. В таком случае, реакция будет считаться окислительной. Например, кислород имеет положительный стандартный электродный потенциал и способен вступать в окислительные реакции.
С другой стороны, отрицательное значение стандартного электродного потенциала указывает на способность элемента восстанавливаться, т.е. принимать электроны. Такие реакции называются восстановительными. Например, металлы, имеющие отрицательные стандартные электродные потенциалы, способны принимать электроны и вступать в реакции восстановления.
Знание стандартных электродных потенциалов не металлов позволяет предсказывать ход реакций и определять, какой элемент будет в реакции окисляться, а какой восстанавливаться. Это важно для понимания электрохимических процессов и применения их в различных областях, таких как батареи, гальванические элементы и электролиз.
Вопрос-ответ

Какие металлы имеют стандартные электродные потенциалы?
Стандартные электродные потенциалы есть у всех металлов. Они характеризуют способность металла вступить в реакцию с раствором своих ионов и электроны в растворе. Металлы с положительными стандартными электродными потенциалами (более высокими), как, например, литий или калий, являются самыми активными металлами. А металлы с отрицательными стандартными электродными потенциалами (более низкими), такие, как ртуть или платина, являются наименее активными металлами.
Зачем нужны стандартные электродные потенциалы не металлов?
Стандартные электродные потенциалы не металлов позволяют определить и сравнить их способность вступать в реакцию с раствором и образовывать свои ионы. Это позволяет предсказать, какие реакции могут происходить между разными не металлами и металлами при контакте в растворе или при электролизе. Например, по электродным потенциалам можно определить, какая реакция произойдет, если поместить медь в раствор серной кислоты. Также стандартные электродные потенциалы не металлов используются при расчете электродных потенциалов гальванических элементов и составлении электрохимических рядов.
