Стандартные электродные потенциалы металлов - это важная физико-химическая величина, которая определяет способность металла отдавать или принимать электроны при взаимодействии с другими веществами. Эти потенциалы являются основой для построения электрохимических рядов и позволяют оценить потенциальную активность металлов в различных окружающих средах.
Стандартные электродные потенциалы металлов измеряются относительно стандартного водородного электрода, который имеет нулевой потенциал. По сути, эти потенциалы показывают разность напряжений между электродами измеряемого металла и стандартного водородного электрода, когда они находятся в контакте с раствором его соли.
Значение стандартного электродного потенциала металла связано с его химической активностью и коррелирует с его способностью к окислению или восстановлению. Металлы с более высокими стандартными потенциалами обычно располагаются выше в ряду и имеют большую активность, поскольку они легче отдают электроны и тем самым более активно участвуют в реакциях окисления.
Примечание: Знание стандартных электродных потенциалов металлов имеет практическое значение в электрохимических процессах, таких как гальванические элементы, электролиз, аккумуляторы и другие технологические процессы, связанные с электрохимией.
Стандартные электродные потенциалы металлов: важность и объяснение
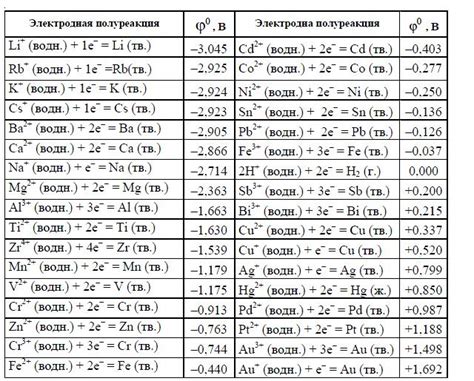
Стандартные электродные потенциалы металлов - это важные характеристики, которые помогают оценить их способность быть окисленными или восстановленными в химических реакциях. Эти потенциалы измеряются относительно стандартного водородного электрода и выражены в вольтах.
Понимание стандартных электродных потенциалов металлов важно для предсказания направления и интенсивности различных электрохимических процессов, таких как гальваническая коррозия и электрохимическая обработка металлов.
У металлов могут быть различные стандартные электродные потенциалы, что связано с их химической активностью. Наиболее реактивные металлы, такие как литий и калий, имеют отрицательные стандартные электродные потенциалы, что означает, что они будут легко окисляться в реакциях. Самые инертные металлы, такие как золото и платина, имеют положительные стандартные электродные потенциалы и не будут легко подвергаться окислительным реакциям.
Знание стандартных электродных потенциалов металлов также позволяет определить относительную силу окислителей и восстановителей в реакциях. Металл с более положительным потенциалом будет действовать как восстановитель, тогда как металл с более отрицательным потенциалом будет действовать как окислитель. Эта информация полезна при ранжировании различных веществ по их активности в электрохимических реакциях.
Таким образом, понимание стандартных электродных потенциалов металлов является важным инструментом в области электрохимии и имеет множество практических применений в различных отраслях, включая материаловедение, химическую промышленность и электроэнергетику.
Значение стандартных электродных потенциалов
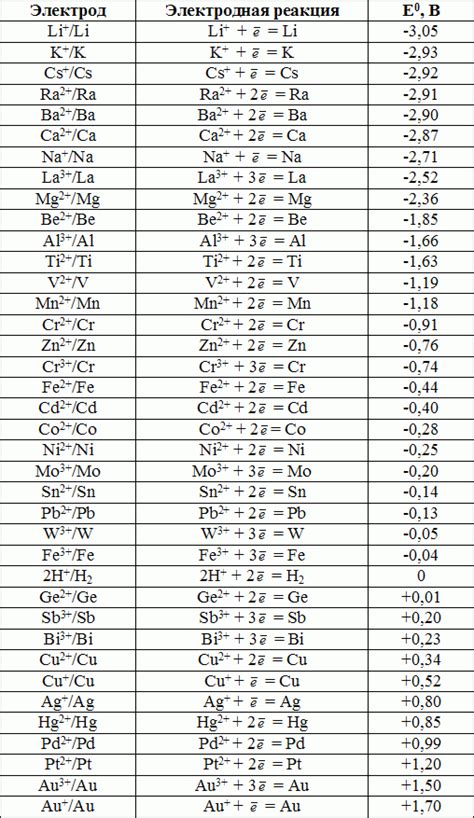
Стандартные электродные потенциалы металлов представляют собой термодинамические величины, которые позволяют оценить относительную способность металлических элементов вступать в химические реакции с ионами водорода. Эти потенциалы измеряются при определенных условиях, в частности, концентрации ионов водорода равной 1 моль/л.
Значение стандартного электродного потенциала представляет собой разность потенциалов между данной электродной половинкой и стандартным водородным электродом при температуре 25°C. Величины стандартных электродных потенциалов металлов могут быть положительными или отрицательными, что указывает на их склонность либо к окислению, либо к восстановлению.
Значение стандартного электродного потенциала металла влияет на его активность в химических процессах. Металлы с более высокими стандартными электродными потенциалами оказываются более активными и склонными к окислению. Такие металлы, как литий, натрий, калий и другие щелочные металлы, имеют положительные стандартные электродные потенциалы и хорошо реагируют с водой или кислородом.
Значение стандартных электродных потенциалов металлов также используется для определения направления электрохимических реакций. При контакте двух разных металлов, электрод с более высоким стандартным электродным потенциалом будет выступать в роли анода, а электрод с более низким стандартным электродным потенциалом - в роли катода.
Понятие и механизмы стандартных электродных потенциалов
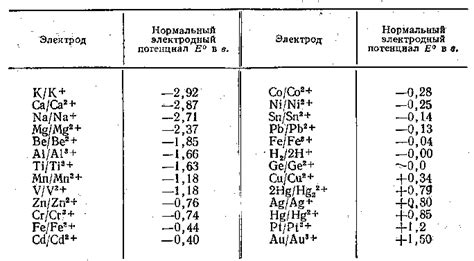
Стандартные электродные потенциалы металлов - это характеристика, которая отражает способность металлов участвовать в реакциях окисления и восстановления.
Стандартные электродные потенциалы измеряют относительно стандартного водородного электрода, который считается идеальной точкой отсчета - его потенциал равен 0 В.
Таким образом, положительные стандартные электродные потенциалы металлов указывают на их способность образовывать катионы, а отрицательные - на способность образовывать анионы.
Механизмы стандартных электродных потенциалов металлов связаны с тем, как электроны передаются от одного вещества к другому при реакциях окисления и восстановления.
- Окисление - это процесс, при котором вещество теряет электроны и становится положительно заряженным ионом. В данном случае происходит перенос электронов с металла на другое вещество, которое выступает в роли окислителя.
- Восстановление - это процесс, при котором вещество получает электроны и становится отрицательно заряженным ионом. В данном случае происходит перенос электронов с вещества на металл, который выступает в роли восстановителя.
Стандартные электродные потенциалы металлов измеряют с использованием специальных электрохимических ячеек, где металлы соединены с соответствующими ионами, а между ними происходит перенос электронов. Полученные данные отражают способность металлов участвовать в электрохимических реакциях и оказывают значительное влияние на практическое применение различных металлов.
Влияние стандартных электродных потенциалов на реакции и процессы:
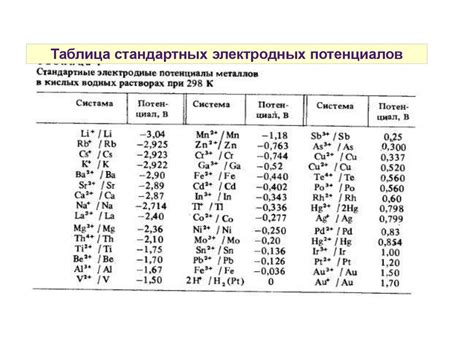
Стандартные электродные потенциалы металлов являются важным показателем их химической активности и реакционной способности. Это величины, которые характеризуют склонность металлов к окислительно-восстановительным реакциям, а именно к передаче электронов другому веществу или получению электронов от него.
Знание стандартных электродных потенциалов металлов позволяет предсказывать возможность протекания различных электрохимических реакций. Более активные металлы, имеющие высокий стандартный электродный потенциал, будут склонны отдавать электроны менее активным металлам, имеющим более низкий потенциал. Такие реакции протекают с выделением энергии и называются экзотермическими.
Влияние стандартных электродных потенциалов металлов на процессы тесно связано с понятием электрохимической коррозии. Некоторые металлы обладают негативным значением стандартного электродного потенциала, что говорит о их высокой склонности к окислительно-восстановительным реакциям. В контакте с окружающей средой, например влажным воздухом или водой, такие металлы подвергаются процессу коррозии, при котором они окисляются и разрушаются. Этот процесс можно считать неблагоприятным, так как приводит к загрязнению окружающей среды и ухудшению качества материалов.
Однако, в некоторых случаях, знание стандартных электродных потенциалов металлов может быть полезно. Например, в гальванических элементах или батареях, различия во значениях потенциалов используются для получения электрической энергии. При этом происходит электрохимическая реакция, в результате которой происходит перенос электронов от одного металла к другому с выделением энергии. Это означает, что стандартные электродные потенциалы металлов прямо влияют на процесс образования электрического тока и может быть использованы в практических целях.
Таким образом, стандартные электродные потенциалы металлов имеют значительное влияние на реакции и процессы, определяя химическую активность металлов и их способность взаимодействовать с другими веществами. Понимание этих потенциалов позволяет прогнозировать возможность происходящих электрохимических реакций и использовать их в различных практических приложениях.
Вопрос-ответ

Какое значение имеют стандартные электродные потенциалы металлов?
Стандартные электродные потенциалы металлов выражают меру их способности вступать в окислительно-восстановительные реакции. Они позволяют оценивать активность и стабильность металла в химических процессах.
Что означают стандартные электродные потенциалы?
Стандартные электродные потенциалы (ЭП) металлов - это физическая характеристика, которая показывает способность металла вступать в окислительно-восстановительные реакции при стандартных условиях (температура 25 °C, давление 1 атмосфера, концентрация ионов 1 М).
Зачем нужно знать стандартные электродные потенциалы металлов?
Знание стандартных электродных потенциалов металлов позволяет предсказывать направление окислительно-восстановительных реакций и потенциал их протекания. Это важная информация для разработки и оптимизации электрохимических процессов, таких как гальваническое покрытие и производство электролиза.
Как можно измерить стандартные электродные потенциалы металлов?
Стандартные электродные потенциалы металлов можно измерить с помощью электродной ячейки, в которой металл и сравниваемый для измерения электрод погружены в растворы своих ионов. Затем измеряется разность потенциалов между двумя электродами и сравнивается с эталонным электродом, обычно сравнивая их с водородным электродом.
