Електрохимические процессы играют важную роль в различных сферах нашей жизни, включая энергетику, электронику, химическую промышленность и другие. Важным аспектом этих процессов является понимание напряжения гальванических элементов, которое определяется стандартными электродными потенциалами металлов.
Стандартные электродные потенциалы металлов - это мера их способности отдавать или принимать электроны в химических реакциях. Они определяются относительно стандартного водородного электрода и измеряются в вольтах. Каждый металл имеет свой уникальный электродный потенциал.
Знание электродных потенциалов металлов позволяет предсказать направление электрохимической реакции и понять, какие металлы образуют пары между собой. Если электродный потенциал первого металла выше, чем у второго, то первый металл будет выступать в роли анода, отдающего электроны, а второй - в роли катода, принимающего электроны. Это позволяет создавать гальванические элементы с высоким напряжением, используя различные металлы.
Важно отметить, что стандартные электродные потенциалы металлов могут изменяться в зависимости от условий, таких как концентрация и состояние раствора, температура и другие факторы. Но несмотря на это, знание этих значений является важным фактором при проектировании и использовании гальванических элементов в различных приложениях.
Стандартные электродные потенциалы металлов и их роль в гальванических элементах

Стандартные электродные потенциалы металлов являются важным показателем их активности в химических реакциях. Электродный потенциал определяет вероятность окисления или восстановления металла и позволяет сравнить его активность с другими металлами.
В гальванических элементах, таких как батареи и аккумуляторы, стандартные электродные потенциалы металлов играют ключевую роль. Они определяют направление потока электронов и позволяют генерировать электрическую энергию.
Металлы с более высоким электродным потенциалом имеют большую способность к окислению, тогда как металлы с более низким электродным потенциалом имеют большую способность к восстановлению. Это позволяет создавать гальванические элементы с различными металлическими парками, где металл с более высоким потенциалом служит анодом (исходным металлом) и происходит его окисление, а металл с более низким потенциалом служит катодом (металлической пластиной, которая принимает поток электронов) и происходит его восстановление.
Такой электрохимический процесс в гальванических элементах позволяет преобразовывать химическую энергию в электрическую и использовать ее для питания электрических устройств. Благодаря знанию стандартных электродных потенциалов металлов можно выбирать подходящие металлические пары для создания эффективных и долговечных гальванических элементов.
Значение стандартных электродных потенциалов металлов
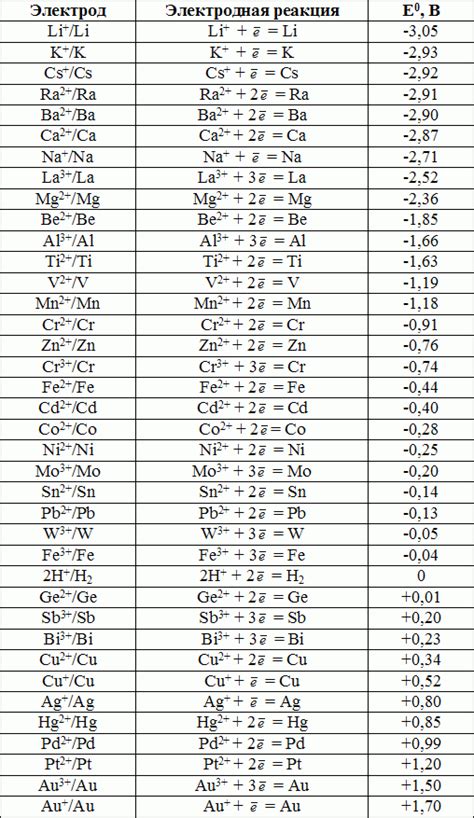
Стандартные электродные потенциалы металлов (ЭПМ) являются важным показателем их химической активности и способности участвовать в электрохимических реакциях. Эти потенциалы измеряются относительно стандартного водородного электрода, который имеет нулевой стандартный электродный потенциал (ЭП).
Значение стандартного электродного потенциала каждого металла, измеренное в отношении стандартного водородного электрода, указывает на его тенденцию к окислительным или восстановительным реакциям. Металлы с более высокими стандартными электродными потенциалами, чем у водорода, называются "активными" металлами, а те, у которых потенциалы ниже нуля, - "инертными".
Значение стандартных электродных потенциалов металлов имеет прямое влияние на напряжение гальванических элементов. При создании гальванической ячейки или батареи из различных металлов, разность в их стандартных электродных потенциалах приводит к возникновению разности потенциалов, которая вызывает направленное движение электронов и ток в цепи.
Используя значения стандартных электродных потенциалов металлов, можно определить направление электродных полуреакций и потенциалы их электрических потенциалов. Это позволяет предсказывать, какие металлы будут окисляться, а какие будут восстанавливаться в электрохимической реакции.
Таким образом, знание значений стандартных электродных потенциалов металлов играет важную роль в различных областях, связанных с электрохимией, а также при проектировании и создании электрохимических устройств и гальванических элементов.
Факторы, влияющие на стандартный электродный потенциал

Стандартный электродный потенциал металла - это величина, характеризующая способность металла отдавать или принимать электроны при реакциях окисления и восстановления. Она зависит от нескольких факторов, которые влияют на его электронную структуру и взаимодействие с окружающей средой.
Первым фактором, который влияет на стандартный электродный потенциал, является химическая природа металла. Каждый металл имеет свой набор электронных уровней и химических свойств, которые определяют его способность отдавать или принимать электроны. Известно, что некоторые металлы, такие как золото и платина, обладают высокими стандартными электродными потенциалами, что делает их устойчивыми к окислению.
Второй фактор, влияющий на стандартный электродный потенциал, - это температура. При повышении температуры возникают изменения в энергетической структуре металла, что может привести к изменению его способности к окислению и восстановлению. Некоторые металлы могут иметь отрицательные температурные коэффициенты стандартного электродного потенциала, что означает, что их потенциал снижается с увеличением температуры.
Третий фактор - концентрация ионов металла в растворе. Концентрация ионов металла оказывает влияние на скорость реакции окисления и восстановления, а следовательно, и на стандартный электродный потенциал. При увеличении концентрации ионов металла стандартный электродный потенциал может изменяться, поскольку большее количество ионов увеличивает вероятность их взаимодействия с другими веществами.
И наконец, четвертым фактором, влияющим на стандартный электродный потенциал, является pH раствора. Реакция окисления и восстановления металла зависит от концентрации водородных и гидроксидных ионов в растворе, которые определяют его кислотно-щелочное состояние. Изменение pH раствора может привести к изменению способности металла принимать или отдавать электроны.
Взаимодействие металлов в гальванических элементах
Гальванический элемент — это устройство, в котором происходит преобразование химической энергии в электрическую за счет электрохимических реакций.
Одним из главных факторов, влияющих на работу гальванического элемента, является взаимодействие металлов. Каждый металл имеет свой стандартный электродный потенциал, который описывает его способность отдавать или принимать электроны. Известно, что у разных металлов стандартные потенциалы разные. Именно эта разница в потенциалах обуславливает возможность генерации электрического тока в гальваническом элементе.
При создании гальванического элемента используются два различных металла, которые погружаются в электролит — раствор, способствующий электрохимическим реакциям. Данная среда обеспечивает движение ионов и электронов между металлами. Когда два металла с разными стандартными потенциалами находятся в электролите, возникает разность потенциалов, и металл с более высоким потенциалом начинает отдавать электроны металлу с более низким потенциалом.
В результате этой электрохимической реакции в гальваническом элементе возникает электрический ток, который можно использовать для питания различных устройств, например, фонариков или мобильных телефонов. Взаимодействие металлов в гальванических элементах позволяет эффективно использовать их стандартные электродные потенциалы и создавать устойчивые источники энергии.
Практическое применение стандартных электродных потенциалов
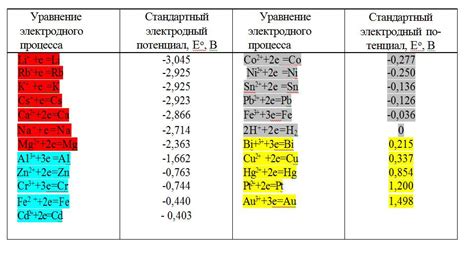
Стандартные электродные потенциалы металлов играют важную роль в практической электрохимии и имеют разнообразные применения.
Одним из основных применений стандартных электродных потенциалов является определение направления и силы электродных реакций. Зная значения стандартных электродных потенциалов металлов, можно определить, какие металлы будут действовать как аноды (отрицательные электроды) или катоды (положительные электроды) в гальванических элементах.
Также стандартные электродные потенциалы металлов используются при расчете электродного потенциала гальванической ячейки. По значениям стандартных потенциалов можно определить напряжение, которое будет возникать при присоединении двух металлов к проводам их соответствующих электродов.
Используя данные о стандартных электродных потенциалах, можно также предсказать, какие металлы будут активно растворяться (окисляться) и какие будут осаждаться (восстанавливаться) в электролите или при взаимодействии с другими веществами. Это имеет важное значение в процессах химической очистки металлов, гальваническом покрытии и других процессах, связанных с электрохимией.
Стандартные электродные потенциалы металлов также находят применение в разработке и улучшении гальванических элементов - батарей и аккумуляторов. Зная стандартные потенциалы металлов, можно подобрать такие комбинации, которые обеспечат оптимальное напряжение и долговечность гальванических элементов.
Вопрос-ответ

Что такое стандартные электродные потенциалы металлов?
Стандартные электродные потенциалы металлов, также известные как электрохимический ряд, это величины, которые отражают способность металлов вступать в реакцию с ионами водорода. Эти потенциалы измеряются относительно водородного электрода и обозначают степень окисления или восстановления металла в растворе.
Как измеряют стандартные электродные потенциалы металлов?
Стандартные электродные потенциалы металлов измеряются путем сравнения потенциала металлического электрода (обычно платинового) с потенциалом стандартного водородного электрода. Разность потенциалов между электродами определяет электродный потенциал металла.
Зачем нужно знать стандартные электродные потенциалы металлов?
Знание стандартных электродных потенциалов металлов позволяет предсказывать направление и интенсивность электрохимических реакций, происходящих в гальванических элементах. Это полезно для определения электродных потенциалов других веществ и проектирования электрохимических устройств.
Какие факторы влияют на электродный потенциал металла?
На электродный потенциал металла могут влиять такие факторы, как концентрация ионов металла и других реагентов в растворе, температура, давление, контакт с другими металлами и наличие катализаторов. Влияние каждого фактора может быть разным в зависимости от конкретной системы.
Какие металлы имеют наибольший электродный потенциал?
Металлы с наибольшим электродным потенциалом обладают наибольшей способностью вступать в реакцию с ионами водорода и, соответственно, наибольшей анодной активностью. Такие металлы, как литий, калий, цинк и алюминий, имеют высокие электродные потенциалы.
