Щелочные металлы - это элементы группы 1 (IA) периодической таблицы, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются своими уникальными химическими и физическими свойствами, и их важно изучать и сравнивать для получения глубокого понимания периодической системы элементов.
Перед нами предстает возможность сравнить характеристики этих металлов. Литий - самый легкий из щелочных металлов и самый низкотемпературный металл, с плотностью меньшей, чем у воды. Он имеет высокую реакционную способность и используется в аккумуляторах и лекарственных препаратах. Натрий - металл серебристо-белого цвета, который легко окисляется на воздухе. Калий имеет низкую плотность и низкую температуру плавления, и широко используется в сельском хозяйстве и промышленности.
Рубидий, цезий и франций - менее широко известные щелочные металлы, но они также имеют уникальные химические свойства. Рубидий используется в ядерных исследованиях и производстве часов. Цезий - самый реактивный щелочной металл, который используется в атомных часах и в некоторых медицинских процедурах. Франций - очень редкий и радиоактивный элемент, который изучается для понимания его свойств и использования в ядерной энергетике.
Исследование свойств щелочных металлов позволяет расширить наше знание о химических элементах и их потенциальных применениях. Таблица и результаты сравнительной характеристики щелочных металлов помогут нам лучше понять их особенности и использование в науке, технологии и промышленности.
Описание щелочных металлов

Щелочные металлы - это группа элементов, включающая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы элементов и имеют ярко выраженные щелочные свойства.
Щелочные металлы обладают рядом характерных черт. Во-первых, они отличаются низким плотным и мягкими металлическими свойствами. Во-вторых, они реагируют с водой, образуя гидроксиды, что проявляется в обливании металла водой с образованием пузырьков водорода. Данный процесс является очень активным и может привести к воспламенению водородной смеси с воздухом.
Также щелочные металлы образуют соли, которые хорошо растворимы в воде. Они обладают высокими температурами плавления и кипения, что обуславливается наличием сильных металлических связей. Благодаря этим свойствам, щелочные металлы широко используются в различных отраслях промышленности, включая производство батареек, стекла, синтез органических соединений и других процессов.
Однако, несмотря на свою широкую применимость, щелочные металлы обладают высокой реактивностью и должны храниться в среде, не содержащей кислород. Они также являются важными элементами для живых организмов, включая человека, и присутствуют во множестве природных источников, таких как соль и пищевые продукты.
Физические свойства щелочных металлов

Щелочные металлы – это элементы первой группы периодической таблицы, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом характерных физических свойств.
Точка плавления и кипения: Щелочные металлы обладают низкой точкой плавления и кипения. Так, литий плавится при температуре всего около 180 °C, а кипит при 1330 °C. Натрий плавится при 98 °C и кипит при 883 °C. Калий плавится при 64 °C и кипит при 774 °C. Это означает, что щелочные металлы могут находиться в жидком состоянии при относительно низких температурах.
Плотность: Щелочные металлы обладают низкой плотностью. Например, литий имеет плотность 0,53 г/см³, натрий – 0,97 г/см³, а калий – 0,86 г/см³. Это делает их относительно легкими и позволяет им плавать на поверхности воды.
Проводимость: Щелочные металлы хорошие проводники электричества. Присутствие одной свободной внешней электронной оболочки позволяет им легко передвигаться и образовывать электрический ток. Это свойство делает их полезными в различных электрических приборах и средствах передвижения.
Мягкость: Щелочные металлы являются мягкими, что значит, что они легко деформируются и могут быть нарезаны ножом. Например, натрий так мягок, что его можно нарезать ножом, а калий может быть нарезан ножницами. Это свойство связано с тем, что щелочные металлы имеют слабую силу связи между атомами, что делает их структуру легко деформируемой.
Цвет: Щелочные металлы имеют характерный металлический блеск и обычно имеют серебристо-белый цвет. Однако, когда они находятся в воздухе, они реагируют с кислородом и образуют оксидные пленки, что может изменить их цвет. Например, натрий может стать серым, а калий может стать серым, фиолетовым или черным в зависимости от степени окисления.
Химические свойства щелочных металлов

Щелочные металлы, такие как литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr), отличаются рядом химических свойств, которые делают их уникальными и полезными в различных областях.
Первое химическое свойство, которое привлекает внимание, это высокая реактивность щелочных металлов. Они очень активно реагируют с водой, образуя щелочные растворы и выделяя водород. Также щелочные металлы легко реагируют с кислородом воздуха, образуя оксиды. Эта реактивность делает их полезными в промышленности, в частности, в производстве стали и алюминия.
Второе химическое свойство щелочных металлов - их способность формировать ионы с положительным зарядом. Обычно щелочные металлы теряют одну электронную оболочку, образуя ионы с зарядом +1. Это делает их хорошими источниками электронов и положительно заряженных ионов в реакциях.
Кроме того, щелочные металлы обладают низкой плотностью и низкой температурой плавления, что делает их удобными для использования в легких сплавах. Они также хорошо проводят тепло и электричество, что делает их полезными в производстве батарей и других электронных устройств.
Также щелочные металлы обладают желтоватым или серебристым оттенком и хорошо растворяются в растворителях, таких как вода и спирт. Из-за своей высокой реактивности, щелочные металлы часто хранятся в некотором виде, чтобы предотвратить их окисление.
Сравнительная характеристика химических свойств щелочных металлов
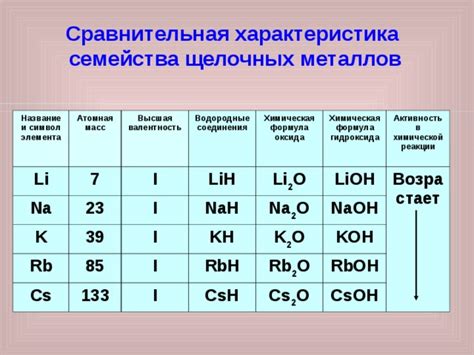
Щелочные металлы - элементы, которые находятся в первой группе периодической системы, включая литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы обладают уникальными химическими свойствами, которые отличают их от других элементов таблицы, и важны для многих научных и промышленных приложений.
1. Активность реакций: Щелочные металлы являются наиболее активными из всех элементов в периодической системе. Они легко реагируют с водой, кислородом и другими химическими веществами, выделяя большое количество тепла и образуя щелочные растворы.
2. Электрохимические свойства: Щелочные металлы обладают высокими электрохимическими характеристиками, что делает их идеальными для использования в батареях и аккумуляторах. Они также являются отличными проводниками электричества и хорошо реагируют с кислородом, образуя оксиды.
3. Растворимость: Щелочные металлы хорошо растворяются в воде, образуя щелочные растворы, которые обладают высоким pH-значением. Литий и натрий растворяются в воде легче других щелочных металлов.
4. Плотность и плавление: Щелочные металлы имеют низкую плотность, что делает их легкими и хорошо плавящимися. Например, литий имеет наименьшую плотность из всех металлов в таблице. Однако, несмотря на низкую плотность, щелочные металлы обладают высокой теплопроводностью и электропроводностью.
5. Формирование сплавов: Щелочные металлы могут образовывать сплавы с другими элементами, такими как алюминий или свинец. Это позволяет использовать их в различных промышленных процессах и производстве специальных материалов.
В целом, щелочные металлы обладают уникальными химическими свойствами, которые делают их полезными во многих областях. Изучение и сравнительная характеристика этих свойств позволяет лучше понять их роль в химических реакциях и применить их в разных областях науки и технологии.
Сравнительная характеристика физических свойств щелочных металлов
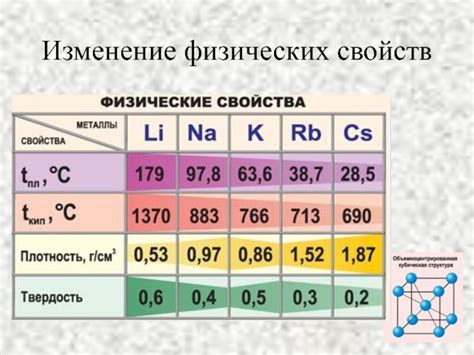
Щелочные металлы – это химические элементы первой группы периодической системы. К ним относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают рядом схожих физических свойств, но также имеют и свои отличительные характеристики.
Плотность: Обычно щелочные металлы очень легкие – литий имеет плотность около 0,53 г/см³, в то время как натрий – около 0,97 г/см³. Более тяжелые щелочные металлы, такие как цезий и франций, имеют плотность около 1,9-2,0 г/см³.
Температура плавления и кипения: Температура плавления уменьшается с увеличением атомного номера в таблице. Например, литий плавится при температуре около 180°С, а калий – при примерно 63°С. Кипение также происходит на невысоких температурах – от 320°С (цезий) до 688°С (литий).
Электропроводность: Щелочные металлы являются хорошими проводниками электричества. Это связано с их низкой энергией ионизации и высокой подвижностью электронов. Калий, натрий и литий хорошо проводят электричество при комнатной температуре. Цезий и франций обладают наивысшей электропроводностью из всех щелочных металлов.
Теплоемкость: У щелочных металлов высокая теплоемкость – это означает, что им требуется много тепла для нагревания. Литий обладает наименьшей теплоемкостью, а франций – высшей теплоемкостью среди всех щелочных металлов.
Твердость: Щелочные металлы являются мягкими, легко поддаваясь деформации. Капли лития или калия можно размять пальцами, а натрий легко режется ножом.
Сравнительная характеристика физических свойств щелочных металлов позволяет провести анализ основных характеристик этих элементов и понять их взаимосвязь и сходства в свойствах.
Таблица со свойствами щелочных металлов
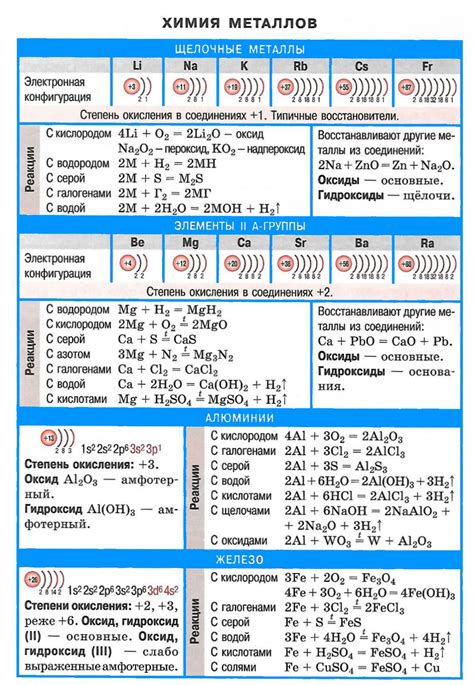
Щелочные металлы – это группа химических элементов, которая включает в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы относятся к первой колонке периодической системы элементов и имеют сходные химические свойства.
Основные характеристики щелочных металлов:
- Атомный номер: в порядке возрастания – 3, 11, 19, 37, 55, 87.
- Атомная масса: 6.94, 22.99, 39.10, 85.47, 132.91, 223.00.
- Электронная конфигурация: s1.
- Внешний электрон: отличается на единицу от предыдущего щелочного металла (Li – 2s1, Na – 3s1, K – 4s1 и т.д.).
- Мягкие металлы, легко реагируют с водой, издают шипящие звуки.
- Высокая электропроводность и теплопроводность.
- Образуют положительные ионы, имеющие единичный положительный заряд.
- Самые реактивные металлы.
Реактивность щелочных металлов связана с высокой энергией ионизации, что обусловлено недостатком электронов во внешней оболочке. В то же время, эта высокая реактивность делает их важными для множества химических процессов и промышленных приложений.
Использование щелочных металлов включает производство щелочей, стекла, удобрений, батарей и других электронных устройств. Кроме того, они могут быть использованы для очистки воды, в пищевой промышленности и в медицине.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
Щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
В чем основное отличие щелочных металлов от других элементов?
Одним из основных отличий щелочных металлов от других элементов является высокая активность этих металлов. Они легко реагируют с водой, кислородом и другими элементами, образуя основания и соли. Кроме того, они обладают низкой плотностью и низкой температурой плавления.
