Атомы металлов и неметаллов отличаются друг от друга не только свойствами, но и структурой электронной оболочки. Электронная оболочка атома состоит из энергетических уровней, на которых располагаются электроны. Разница в количестве электронов у атомов металлов и неметаллов в одном периоде определяет их химические свойства и способность образовывать химические связи.
Металлы - это элементы, которые обладают хорошей проводимостью электричества и тепла, блестящей поверхностью, высокой пластичностью и тугоплавкостью. Атомы металлов имеют обычно одну или несколько электронных оболочек, заполненные электронами. Количество электронов на внешнем энергетическом уровне металлов обычно меньше, чем у атомов неметаллов в одном периоде. Это обусловлено тем, что у металлов наиболее вероятные энергетические уровни электронов ближе к ядру и легко заполняются.
Неметаллы, напротив, обладают плохой проводимостью электричества и тепла, матовой поверхностью, хрупкостью и низкой тугоплавкостью. Атомы неметаллов имеют обычно несколько электронных оболочек, неполностью заполненные электронами. Количество электронов на внешнем энергетическом уровне неметаллов обычно больше, чем у атомов металлов в одном периоде. Это обусловлено тем, что у неметаллов наиболее вероятные энергетические уровни электронов находятся дальше от ядра и труднее заполняются.
Таким образом, разница в количестве электронов у атомов металлов и неметаллов в одном периоде связана с различиями в структуре электронной оболочки и определяет их химические свойства. Металлы и неметаллы имеют разную способность образовывать химические связи, что позволяет им взаимодействовать с другими элементами и составлять разнообразные химические соединения.
Количественная разница электронов у атомов металлов и неметаллов в одном периоде
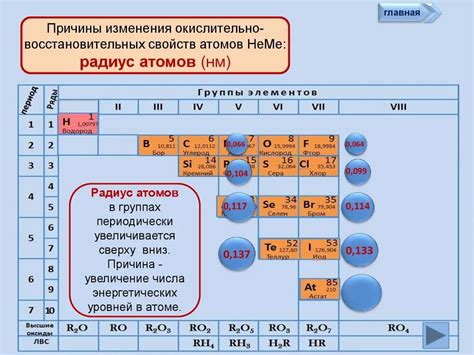
Один из основных факторов, определяющих свойства и химическую активность веществ, - это количество электронов в атоме. В одном периоде таблицы элементов количество электронов у атомов металлов и неметаллов обычно различается.
Металлы обычно находятся в левой части таблицы элементов и имеют меньшее количество электронов в внешней оболочке, чем неметаллы в том же периоде. У металлов внешняя оболочка содержит обычно 1-3 или максимум 4 электрона. Это позволяет металлам легко отдавать электроны и образовывать положительные ионы в реакциях с неметаллами.
В то же время, неметаллы, расположенные в правой части таблицы элементов, имеют большее количество электронов в внешней оболочке - от 5 до 8 электронов. Неметаллы обычно стремятся получить дополнительные электроны для заполнения своей внешней оболочки и образовывать отрицательные ионы при взаимодействии с металлами. Это делает неметаллы электроотрицательными, то есть они обладают большой способностью притягивать электроны.
В итоге, различие в количестве электронов у атомов металлов и неметаллов в одном периоде таблицы элементов определяет их химическую активность и способность образовывать соединения. Металлы, имеющие меньшее количество электронов, часто являются реагентами, отдающими электроны, а неметаллы, имеющие большее количество электронов, - акцепторами электронов.
Металлы и неметаллы: общие черты и различия

Металлы и неметаллы - это основные классы элементов химической таблицы. Металлы обладают следующими особенностями: высокая теплопроводность и электропроводность, глянцевая поверхность и способность образовывать ионы с положительным зарядом. Они находятся в левой части периодической системы элементов и включают в себя такие элементы, как железо, алюминий и медь.
С другой стороны, неметаллы обладают низкой электропроводностью и теплопроводностью, а также могут образовывать ионы с отрицательным зарядом. Они расположены в правой части периодической системы элементов и включают в себя такие элементы, как углерод, кислород и азот.
Одним из основных отличий между металлами и неметаллами является различие в количестве электронов во внешней электронной оболочке атома. Металлы обычно имеют малое количество электронов во внешней оболочке и готовы отдавать электроны, чтобы образовать положительные ионы. Неметаллы, напротив, имеют более полные внешние оболочки и образуют отрицательные ионы, принимая электроны от других элементов.
Еще одной отличительной чертой металлов и неметаллов является их поведение при контакте с кислородом. Металлы обычно реагируют с кислородом, образуя оксиды, которые могут иметь щелочной, кислотный или амфотерный характер. Неметаллы тоже могут реагировать с кислородом, образуя оксиды, которые обычно имеют кислотный характер.
В таблице ниже приведены примеры некоторых общих особенностей металлов и неметаллов:
| Металлы | Неметаллы |
|---|---|
| Высокая теплопроводность | Низкая теплопроводность |
| Высокая электропроводность | Низкая электропроводность |
| Глянцевая поверхность | Матовая поверхность |
| Образуют ионы с положительным зарядом | Образуют ионы с отрицательным зарядом |
Таким образом, металлы и неметаллы имеют ряд общих черт, но также отличаются друг от друга своими физическими и химическими свойствами. Понимание этих различий помогает нам лучше понять, как элементы взаимодействуют друг с другом и как они могут использоваться в различных областях науки и технологии.
Состав атома: электроны, протоны, нейтроны

Атомы, являющиеся фундаментальными частицами вещества, состоят из трех основных подчастиц - электронов, протонов и нейтронов.
Электрон - отрицательно заряженная элементарная частица, находится вокруг ядра атома в электронных оболочках. Оболочки могут иметь разное количество электронов, которое определено энергетическим уровнем. Электроны обеспечивают химические связи и участвуют в реакциях между атомами.
Протон - положительно заряженная частица, находится в ядре атома. Суммарный заряд ядра определяет химические свойства элемента. Количество протонов в ядре определяет атомный номер элемента и его положение в периодической таблице.
Нейтрон - частица без заряда, находится в ядре атома вместе с протонами. Нейтроны определяют массовое число атома и влияют на его стабильность. Изменение числа нейтронов в атоме приводит к образованию изотопов элемента, которые имеют одинаковое количество протонов, но разное количество нейтронов.
Электронная конфигурация атомов

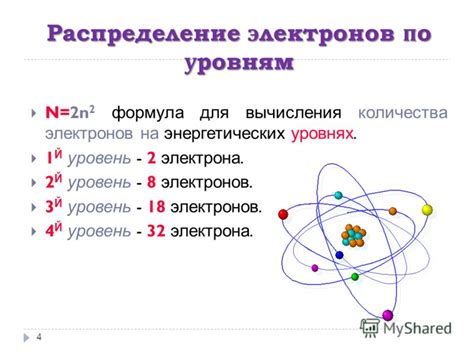
Электронная конфигурация атомов определяет распределение электронов в энергетических уровнях атома. Каждый электрон может находиться в определенном энергетическом состоянии, относящемся к одному из энергетических уровней. Электронная конфигурация атома может быть представлена числовой последовательностью, где каждая цифра обозначает максимальное число электронов в определенном энергетическом уровне.
Существует несколько правил и закономерностей, влияющих на электронную конфигурацию атомов. Например, правило заполнения электронных оболочек гласит, что электроны заполняют энергетические уровни в порядке возрастания их энергии. Также известно, что на каждом энергетическом уровне может содержаться определенное число подуровней, обозначаемых буквами s, p, d, f.
В периодической системе элементов все атомы класфицируются в соответствии с их атомным номером. Атомный номер определяет количество электронов в атоме. На каждом уровне атомского порядка в периоде количество электронов увеличивается на единицу. Так, в первом периоде всего две группы элементов: металлы (литий, натрий, калий) и неметаллы (водород, гелий). У лилития и натрия имеются одна и та же оболочка s1, но литий - неметалл, а натрий - металл. Различие в их свойствах объясняется не только количеством электронов в электронной оболочке, но и другими факторами, такими как радиус атома и электроотрицательность.
Таким образом, различие в количестве электронов у атомов металлов и неметаллов в одном периоде может иметь влияние на баланс электрических зарядов и химические свойства элементов. Количество электронов в проводимости металлов влияет на их способность образовывать ионные связи, тогда как неметаллы, имеющие большее количество электронов, обладают большей электроотрицательностью и имеют тенденцию к образованию ковалентных связей.
Периодическая таблица элементов
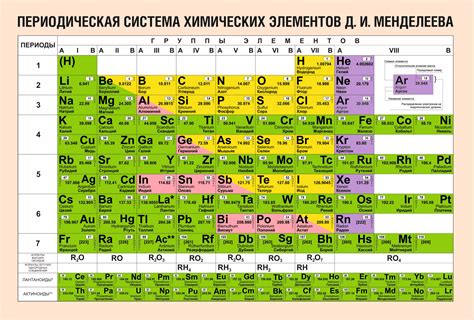
Периодическая таблица элементов - удобный инструмент, используемый в химии для организации и систематизации информации о различных химических элементах. Эта таблица представляет собой упорядоченную систему, в которой элементы располагаются по возрастанию атомных номеров. Каждый элемент в таблице имеет свою уникальную символическую обозначение, а также указаны его атомный номер и относительная атомная масса.
Таблица состоит из периодов (горизонтальных строк) и групп (вертикальных столбцов). Каждый период соответствует новому энергетическому уровню, а каждая группа содержит элементы с одинаковым количеством валентных электронов во внешней электронной оболочке.
В одном периоде таблицы обычно находятся как металлы, так и неметаллы. Металлы имеют относительно низкую электронную аффинность и склонны отдавать электроны, образуя положительные ионы. В то время как неметаллы имеют высокую электронную аффинность и склонны принимать электроны, образуя отрицательные ионы.
Важно отметить, что количество электронов у атомов металлов и неметаллов в одном периоде может отличаться. Например, в первом периоде таблицы находятся литий (Li) и фтор (F). Литий имеет 3 электрона, а фтор - 9 электронов. Эта разница в количестве электронов обусловлена разной электронной конфигурацией атомов металлов и неметаллов.
Расположение металлов и неметаллов в таблице

В таблице Менделеева металлы и неметаллы расположены по разным сторонам, отражая основные различия между ними. Металлы находятся слева от линии, проходящей через группу 14, в то время как неметаллы расположены справа от этой линии.
Одной из основных характеристик металлов является их способность отдавать электроны в процессе химических реакций, что обуславливает их положение в левой части таблицы. Металлы обладают низкой электроотрицательностью и обычно образуют положительные ионы, которые легко связываются с отрицательно заряженными неметаллами.
Неметаллы, находясь справа от линии в таблице Менделеева, обладают высокой электроотрицательностью и обычно принимают электроны от металлов, образуя отрицательные ионы. Они часто образуют сильные и неполярные ковалентные связи и могут проявлять хорошие свойства изоляторов в электрическом и тепловом отношениях.
В одном периоде в таблице Менделеева, количество электронов у атомов металлов и неметаллов отличается. Металлы обычно имеют меньшее количество электронов в внешней оболочке, что делает их более склонными к потере электронов и образованию положительных ионов. Неметаллы, напротив, имеют большее количество электронов в внешней оболочке, что делает их более склонными к приобретению электронов и образованию отрицательных ионов.
Количество электронов у атомов металлов в одном периоде
Атомы металлов и неметаллов имеют разное количество электронов в своих внешних энергетических оболочках. В одном периоде таблицы элементов количество электронов у атомов металлов и неметаллов различно. Металлы, как правило, имеют меньшее количество электронов на внешней оболочке, чем неметаллы.
В таблице Менделеева атомы металлов расположены слева от прогрессирующей линии, разделяющей металлы и неметаллы. Металлы находятся в левой части таблицы, где периоды имеют большее количество элементов. Необитаемые металлы находятся в верхней части таблицы.
Атомы металлов в одном периоде имеют общую электронную формулу. Их внешние энергетические оболочки содержат меньшее количество электронов, что делает их более склонными к потере электронов и образованию положительного заряда. Это объясняет химическую активность металлов и их способность образовывать ионы положительного заряда при взаимодействии с неметаллами.
Количество электронов у атомов металлов в одном периоде также влияет на их металлические свойства, такие как электропроводность и теплопроводность. Большее количество электронов на внешней оболочке позволяет металлам легко передавать электроны и энергию, что делает их хорошими проводниками.
В целом, количество электронов у атомов металлов в одном периоде является одним из факторов, определяющих их химические и физические свойства. Различия в количестве электронов между металлами и неметаллами позволяют им образовывать разные типы химических связей и обладать разными химическими свойствами.
Количество электронов у атомов неметаллов в одном периоде

Атомы неметаллов, в отличие от атомов металлов, обладают отличительными свойствами, включая различное количество электронов в их электронных оболочках. В периоде, атомы неметаллов могут иметь разные конфигурации электронов, определяющие их химическую активность и способность образовывать химические связи.
В первом периоде периодической таблицы находятся атомы водорода и гелия. Атом водорода имеет всего один электрон, который находится в единственной шкале. В результате этого, атом водорода легко образует ковалентные и ионные связи с другими элементами, потому что он стремится достичь стабильности, получая или отдавая электроны.
Атом гелия также находится в первом периоде, но отличается от атома водорода тем, что его электронная оболочка уже заполнена двумя электронами. Благодаря этой заполненной оболочке, атом гелия становится стабильным и малоактивным химическим элементом.
В последующих периодах, атомы неметаллов таких элементов как кислород, азот, фтор, хлор и другие, имеют больше электронов в своих электронных оболочках. Кислород, например, имеет 8 электронов, а атом азота - 7. Это делает их более реактивными и способными образовывать множество химических соединений.
Таким образом, количество электронов у атомов неметаллов в одном периоде может значительно варьироваться, что определяет их свойства и способность к реакциям с другими элементами.
Вопрос-ответ

Почему у атомов металлов в одном периоде обычно больше электронов, чем у атомов неметаллов?
У атомов металлов внешний электронный уровень находится далеко от ядра и может вместить больше электронов по сравнению с атомами неметаллов, у которых внешний электронный уровень находится ближе к ядру и вмещает меньшее количество электронов. В результате атомы металлов могут образовывать положительные ионы, отдавая свои внешние электроны, в то время как атомы неметаллов могут образовывать отрицательные ионы, принимая электроны от других атомов.
