Щелочи – это химические соединения, которые относятся к классу оснований и обладают значительной щелочностью. Они широко используются в различных областях промышленности, медицины и научных исследований. Реакция металла с щелочью – одна из важнейших химических реакций, которая не только позволяет получить соединения с новыми свойствами, но и является основой для создания множества продуктов, которые используются в нашей повседневной жизни.
Первоначально металлы были открыты и исследованы еще в древности, и стало ясно, что они обладают такими свойствами, как твердость, проводимость тепла и электричества, блеск и другие. Взаимодействие металла с щелочью приводит к образованию новых соединений, которые обладают уникальными химическими и физическими свойствами.
Реакция металла с щелочью особенно интересна из-за возможности получить гидроксиды, крупных и, самое главное, стабильных классов химических соединений. Гидроксиды имеют широкий спектр применения, они используются в качестве катализаторов, в процессе очистки воды, в медицине и других сферах. Таким образом, реакция металла с щелочью играет важную роль в современной науке и промышленности.
Взаимодействие металла и щелочи

Реакция металлов с щелочью является одним из наиболее известных и широко изученных процессов в химии. При этом взаимодействии происходит обмен электронов между металлом и щелочью, что приводит к образованию соединения, называемого гидроксидом металла.
Взаимодействие металла с щелочью обладает несколькими особенностями. Во-первых, металлы реагируют с щелочью только при наличии воды. Во-вторых, скорость реакции зависит от таких факторов, как концентрация щелочи, температура и размер частиц металла. В-третьих, при взаимодействии металла с щелочью может выделяться газ, что является одним из признаков реакции.
Применение реакции металла с щелочью широко разнообразно. Гидроксиды металлов, образованные в результате этой реакции, имеют множество применений в различных отраслях науки и промышленности. Например, натриевый гидроксид (щелочь) используется в процессе мыльного производства, а калиевый гидроксид применяется в электролитических процессах и производстве маслорастворимых красителей.
Механизм реакции

Реакция металла с щелочью основана на образовании гидроксида металла и выделении водорода. Для начала реакции необходимо преодолеть покров оксида на поверхности металла. Это обеспечивается растворением щелочи в воде, что позволяет проникнуть ей в металл и разрушить оксидную пленку.
В процессе реакции щелочь активно реагирует с металлом, образуя соединение - гидроксид металла. Это соединение обладает щелочными свойствами и отличается высокой растворимостью в воде.
Сопровождающим процессом реакции металла с щелочью является выделение водорода. Он образуется в результате разложения воды на атомы кислорода и водорода под воздействием металла. Водород выделяется в виде пузырьков газа и может воспламеняться при присутствии искры или открытого огня.
Реакция металла с щелочью особенно интенсивна водах. Вода обеспечивает не только растворение щелочи, но и создает условия для быстрого протекания химических процессов. Щелочные растворы металлов имеют широкое применение в различных областях, включая химическую промышленность, производство пищевых продуктов и фармацевтику.
Образование соединения
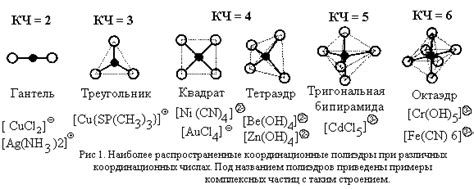
Реакция металла с щелочью приводит к образованию особых соединений, называемых гидроксидами металлов. Гидроксиды металлов представляют собой вещества, состоящие из атомов металла и группы гидроксила (OH-). Это важные соединения, которые широко применяются в различных отраслях нашей жизни.
Образование гидроксидов металлов происходит следующим образом. Когда металл вступает в реакцию с щелочью, обычно натрием или калием, происходит замещение водорода из молекулы гидроксида. Например, при реакции натрия с водой образуется натриевый гидроксид и выделяется водород. Таким образом, металл вступает в реакцию с гидроксидной группой, образуя гидроксид металла.
Гидроксиды металлов обладают определенными свойствами. Они обычно представляют собой кристаллические вещества, хорошо растворимые в воде. В водных растворах гидроксиды металлов образуют гидроксоны и ионы металла. Гидроксиды обладают щелочными свойствами и могут нейтрализовать кислоты. Они также могут использоваться в качестве осаждателей при очистке воды и в процессе производства различных химических веществ.
Таким образом, реакция металла с щелочью приводит к образованию гидроксидов металлов, которые имеют широкое применение в различных сферах нашей жизни.
Физико-химические свойства соединения

Соединение металла с щелочью представляет собой соль, образующуюся в результате реакции между металлом и гидроксидом щелочи. Это соединение обычно является кристаллическим веществом, хорошо растворимым в воде. Оно обладает некоторыми уникальными физико-химическими свойствами.
Плавучесть: соединение металла с щелочью имеет меньшую плотность по сравнению с водой, что позволяет ему плавать на поверхности. Это свойство используется в практике при производстве алюминия и других металлов.
Растворимость: соединение хорошо растворимо в воде, что делает его полезным при приготовлении растворов для различных химических процессов, включая производство жидкого мыла и стекла.
Кислотное свойство: соединение металла с щелочью обладает щелочными свойствами и может участвовать в кислотно-щелочных реакциях, образуя соли и воду. Это свойство используется в аналитической химии для определения кислотности различных растворов.
Проводимость электричества: соединение металла с щелочью обычно является электролитом и способно проводить электрический ток. Это свойство используется в батареях и аккумуляторах, где соединение служит электролитом.
Итак, физико-химические свойства соединения металла с щелочью делают его полезным в различных областях промышленности и лабораторной практике, а также в повседневной жизни.
Виды соединений металла с щелочью

Соединения металла с щелочью являются одними из основных типов реакций, которые могут происходить между металлами и щелочами. В результате таких реакций образуются различные соединения, которые могут иметь разную природу и свойства.
Одним из типов соединений металла с щелочью являются гидроксиды. Это вещества, состоящие из катиона металла и аниона гидроксильной группы (OH-). Гидроксиды металлов, такие как натрий, калий, литий, обладают выраженной щелочностью и широко используются в различных отраслях промышленности.
Еще одним видом соединений металла с щелочью являются алюминаты. Алюминаты металлов формируются при реакции алюминия или его соединений с щелочью. Они обладают разнообразными свойствами и применяются в производстве стекла, эмалей, керамики и других материалов.
Также нельзя не упомянуть о карбонатах, которые возникают в результате реакции металлических катионов с углекислыми щелочами. Карбонаты представляют собой основной класс минералов, широко распространенных в природе, и также применяются в различных отраслях промышленности.
В зависимости от металла и щелочи, которые участвуют в реакции, возможно образование и других видов соединений. Каждое из них обладает своими уникальными свойствами и применением в различных отраслях науки и техники.
Практическое применение соединения

Соединение, получаемое в результате реакции металла с щелочью, находит широкое применение в различных областях науки и промышленности.
Одним из наиболее распространенных применений этого соединения является его использование в процессе очистки воды. Образующийся при реакции гидроксид металла (щелочь) является мощным осаждающим и улавливающим агентом. Он способен связывать и осаждать различные загрязнения из воды, такие как ионы тяжелых металлов и органические вещества. Таким образом, соединение металла с щелочью используется для очистки сточных вод, производства питьевой воды и обработки промышленных отходов.
Другим важным применением соединения является его использование в процессе нейтрализации кислот. Гидроксид металла обладает высокой щелочностью, поэтому он может применяться для нейтрализации кислых растворов. Это особенно важно в промышленности, где кислотные отходы могут быть опасными и токсичными. Реакция с щелочью позволяет безопасно и эффективно нейтрализовать кислые растворы и обезвредить их.
Кроме того, соединение металла с щелочью широко используется в качестве сильных оснований в различных процессах химического синтеза. Гидроксид металла может быть использован для регулирования pH растворов, а также как агент для протекания различных химических реакций. Благодаря своим щелочным свойствам, соединение металла с щелочью нашло применение в производстве лекарств, процессе гидролиза органических соединений и других химических процессах.
Таким образом, соединение металла с щелочью имеет широкий спектр применения в различных отраслях. Оно используется в очистке воды, нейтрализации кислот и в химическом синтезе. Это связано с его высокими осадочными свойствами и способностью к нейтрализации кислотных растворов. При правильном использовании такого соединения можно достичь эффективных результатов в очистке и обработке различных материалов.
Примеры использования
Реакция металла с щелочью имеет широкий спектр применений в различных отраслях промышленности и научных исследованиях.
1. Производство щелочных металлов
Металлы, такие как литий, натрий и калий, производятся путем реакции соответствующего металла с щелочью. Полученные металлы широко используются в батареях, сплавах, пищевой и фармацевтической промышленности.
2. Выработка водорода
Реакция металла с щелочью может использоваться для выработки водорода. При контакте с водой щелочные металлы высвобождают молекулы водорода, которые могут быть использованы в различных процессах, таких как производство аммиака или электролиз воды.
3. Производство гидроксидов
Реакция металла с щелочью приводит к образованию гидроксидов металлов. Гидроксиды натрия, калия и других щелочных металлов используются в различных отраслях промышленности, включая химическую, стекольную и нефтехимическую.
4. Очистка отходов и обеззараживание
Щелочные металлы широко применяются для очистки отходов и обеззараживания. Реакция металла с щелочью способна нейтрализовать опасные и токсичные вещества, такие как кислоты или ядовитые газы, что делает ее полезной в процессе очистки и деонтаминации.
5. Исследования и образование
Реакция металла с щелочью также может быть использована в научных исследованиях и образовательных целях. Это может включать изучение свойств отдельных металлов, исследование кинетики реакции или проведение химических экспериментов в школах и университетах.
Вопрос-ответ

Какие металлы реагируют с щелочью?
Реагировать с щелочью могут различные металлы, такие как натрий, калий, литий, цинк и многие другие. Однако, не все металлы реагируют с щелочью одинаково, так как их реакционная способность зависит от многих факторов, включая их электрохимические свойства и степень активности.
Чему образованию приводит реакция металла с щелочью?
Реакция металла с щелочью приводит к образованию гидроксида металла и выделению водорода. В зависимости от металла и щелочи, образующийся гидроксид может быть разного типа, например, гидроксид натрия или гидроксид калия.
Где используется реакция металла с щелочью?
Реакция металла с щелочью имеет множество применений. Например, гидроксиды натрия и калия, образующиеся при реакции соответствующих металлов с щелочью, являются важными компонентами в производстве стекла, мыла, моющих средств и других продуктов. Кроме того, эти гидроксиды используются в химическом и фармацевтическом производстве, а также в лабораторных исследованиях.
Какие особенности соединения металла с щелочью следует учитывать?
Соединение металла с щелочью имеет несколько особенностей, которые следует учитывать. Во-первых, реакция может быть сильно экзотермической, то есть сопровождаться выделением большого количества тепла. Во-вторых, реакция может протекать очень быстро, особенно если металл активный. Кроме того, образующийся водород является горючим, поэтому при проведении реакции следует быть осторожным и предпринимать соответствующие меры предосторожности.
