Водород – самый легкий элемент в периодической таблице, его атом состоит из одного протона и одного электрона. Этот газ является важным энергетическим ресурсом и используется в различных областях, включая производство электричества, водородные топливные элементы и производство химических веществ.
Один из способов получения водорода – реакция металлов с кислотами. Когда металл вступает в контакт с кислотой, происходит экзотермическая химическая реакция, при которой выделяется водородный газ. Для этого обычно используют металлы, такие как цинк, алюминий или железо, и кислоты, включая соляную кислоту или серную кислоту.
Это важный метод получения водорода, который находит применение не только в лаборатории, но и в промышленности. Реакция металлов с кислотами может быть использована для создания маленьких установок по получению водорода, которые могут быть использованы для выработки энергии в отдаленных районах или на местах, где нет доступа к электроэнергии.
Этот метод получения водорода имеет свои преимущества и недостатки. Он относительно прост в исполнении, дешев и эффективен. Однако, реакция металлов с кислотами может быть опасной и требует осторожности при выполнении.
Химическая реакция, при которой металл вступает в контакт с кислотой и образуется водород, является одним из примеров реакции окисления-восстановления. В момент реакции, металл окисляется, а протоны из кислоты принимают электроны от металла, образуя водород. Этот метод получения водорода демонстрирует основы химии и может быть использован для обучения студентов и любопытных изучателей науки.
Металлические реакции
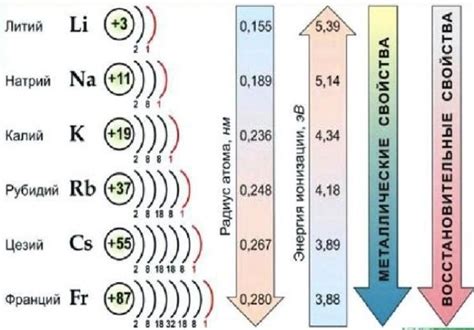
Реакция металлов с кислотами является одним из способов получения водорода. Эта реакция основана на активности металлов и способности кислоты отдавать протоны. Когда металл вступает в контакт с кислотой, происходит окислительно-восстановительная реакция, при которой металл окисляется, а водород выделяется в виде газа.
Наиболее распространенным металлом для реакции с кислотой является цинк. Это связано с его высокой активностью и надежностью. При взаимодействии цинка с кислотой образуется хлорид цинка и выделяется водород.
Однако помимо цинка, реакцию можно провести с другими металлами, такими как алюминий, железо или магний. В каждом случае, в результате взаимодействия металла с кислотой, образуется соль и выделяется водород, который можно использовать в различных технических процессах.
Металлические реакции позволяют получить водород эффективно и экономично. Однако при проведении таких реакций необходимо соблюдать осторожность, так как некоторые кислоты могут быть опасными. Кроме того, не все металлы могут быть использованы для этой реакции, так как некоторые из них недостаточно активны и не реагируют с кислотами. Поэтому важно выбирать правильную комбинацию металла и кислоты для достижения максимальной эффективности.
Взаимодействие с кислотами

Вещества, такие как металлы, могут вступать в реакцию с различными кислотами. Например, алюминий взаимодействует с серной кислотой, образуя алюминийсульфат и выделяя водородный газ. При этой реакции образуется сильностягиваемая сероводородная мембрана, которую можно легко обнаружить по его запаху, поскольку сероводород обладает сильным запахом гнили и яиц.
Кроме того, некоторые металлы, например, цинк и железо, могут реагировать с соляной кислотой. При этом образуются хлориды металлов и выделяется водород. Эти реакции также можно обнаружить по запаху едингайки, вызванному выделением водорода.
Взаимодействие металлов с кислотами является одним из способов получения водорода. Кроме того, эти реакции широко используются в промышленности и научных исследованиях для получения водорода в целях энергетических и химических процессов.
Выбор металла

Для получения водорода с помощью реакции металлов и кислоты необходимо выбрать подходящий металл. Различные металлы могут образовывать разные вещества в результате реакции, поэтому выбор металла является важным шагом в этом процессе.
Наиболее часто используемыми металлами для этой реакции являются цинк и алюминий. Они обладают высокой реакционной активностью и хорошо взаимодействуют с кислотами, образуя соль и выделяя водород. Цинк и алюминий легко доступны и относительно недороги, что делает их удобным выбором для этой цели.
Однако, помимо цинка и алюминия, также можно использовать другие металлы, такие как железо или магний. В зависимости от выбранного металла, скорость реакции и количество выделяющегося водорода могут отличаться. Некоторые металлы могут быть менее реакционно-активными и требовать использования более концентрированной кислоты для достижения желаемого результата.
Следует помнить, что при выборе металла для реакции с кислотой необходимо учесть его химические свойства, стоимость и доступность. Также важно обеспечить безопасность при проведении эксперимента и правильно выбрать кислоту, чтобы минимизировать возможные риски и обеспечить эффективность процесса получения водорода.
Физические свойства водорода

Плотность и состояние: Водород является самым легким элементом в таблице Mendeleev и обладает очень низкой плотностью, составляющей всего 0,089 г/л при нормальных условиях.
Агрегатное состояние: Водород может существовать в трех агрегатных состояниях: газообразном, жидком и твердом. При низких температурах и высоком давлении водород переходит в жидкое или твердое состояние.
Температурный интервал: Кипение водорода происходит при температуре -252,87°C, а замерзание при -259,16°C. То есть водород имеет очень низкую температуру замерзания и кипения.
Цвет и запах: Водород — бесцветный и беззапашный газ, что делает его невосприимчивым для человеческого восприятия. Это означает, что водород не обладает видимым цветом и не имеет характерного запаха.
Растворимость и проводимость: Водород слабо растворяется в воде, его растворимость равна около 0,018 г на 100 г воды при 0°C. Водород также является плохим проводником электричества и тепла, однако его проводимость увеличивается с повышением давления.
Применение водорода
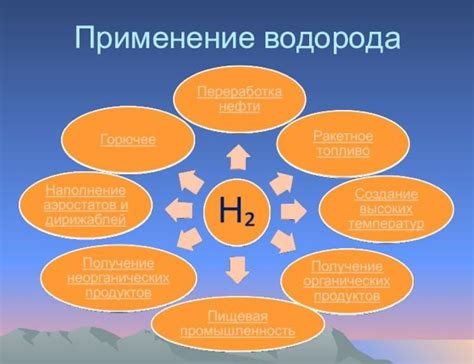
Водород является важным элементом во многих отраслях промышленности. Его основное применение связано с использованием в качестве источника энергии. Водород используется в топливных элементах, которые могут преобразовывать химическую энергию в электроэнергию и тепло. Такие топливные элементы могут использоваться в автомобилях, генераторах и в других устройствах, где требуется эффективный и экологически чистый источник энергии.
Водород также применяется в космической отрасли. Он может использоваться как топливо для ракетных двигателей и применяться для создания жидкого топлива. Водород обладает высокой энергетической плотностью, что делает его привлекательным вариантом для использования в космических миссиях.
Еще одно важное применение водорода связано с его использованием в производстве аммиака. Аммиак используется в промышленности для производства удобрений, пластмасс, красителей и других химических веществ. Процесс производства аммиака называется габер-Боша и основан на реакции между водородом и азотом.
Водород также используется в производстве стали, для обработки металлов и в других отраслях промышленности. Он может использоваться в качестве атмосферной среды для некоторых процессов обработки металлов, таких как сварка, нагрев и термообработка.
Наконец, водород имеет перспективное применение в сфере энергетики. Одним из многообещающих направлений - это использование водорода в процессе производства и хранения электричества в виде водородной энергии. Такой подход позволяет эффективно хранить и транспортировать энергию, а также использовать ее на пиковых нагрузках и в удаленных районах. Этот метод считается одним из возможных путей к созданию устойчивой энергетической системы.
Важность получения водорода

Водород является одним из самых важных химических элементов, который используется во многих отраслях промышленности и науки. Получение водорода имеет огромное значение для современного общества.
Первое важное применение водорода – это использование его в качестве источника энергии. Водород является чистым и эффективным топливом, и его сжигание не производит вредных выбросов в атмосферу. Поэтому получение водорода позволяет нам двигаться в сторону устойчивого развития и экологической энергетики.
Кроме того, водород используется в процессе производства различных химических веществ, включая аммиак, метанол, метан и многие другие. Получение водорода является необходимым шагом в химической промышленности для производства этих важных веществ.
Водород также применяется в качестве агента редукции в металлургической промышленности. Он способен связываться с кислородом, что позволяет уменьшить содержание кислорода в металлах и снизить их окислительные свойства. Получение водорода является важным этапом обработки металла перед его использованием в различных индустриальных процессах.
Кроме того, водород может использоваться для хранения энергии. Водородные батареи способны запасать энергию и освобождать ее при необходимости. Получение водорода может играть важную роль в развитии энергетики будущего, основанной на возобновляемых источниках.
Получение водорода является процессом, который требует специальных знаний и технологий. Однако, благодаря его многообразным применениям, получение водорода играет важную роль в различных отраслях промышленности и науки.
Безопасность работы с водородом

Работа с водородом может быть опасной и требует соблюдения определенных мер предосторожности
Первоначально, важно принять во внимание, что водород – легковоспламеняющийся газ, и его использование требует строгого соблюдения мер безопасности.
При работе с водородом необходимо обеспечить хорошую вентиляцию помещения, так как водород является легче воздуха и может скапливаться в верхних частях помещения, что может привести к аварийным ситуациям.
Также следует избегать применения открытого огня или любых источников зажигания вблизи мест, где происходит работа с водородом. Возможно использование специальной аппаратуры для горения водорода с целью его безопасного удаления.
При обращении с веществами, содержащими водород, необходимо надевать специальные средства защиты, такие как перчатки, очки и защитные костюмы. Это поможет предотвратить контакт с веществом и защитить практикантов от возможных опасных последствий.
В случае аварийных ситуаций связанных с водородом, необходимо немедленно принять все меры для безопасно эвакуации людей из опасной зоны и вызвать специализированные службы.
- Не играть огнем;
- Избегать скапливания в помещении;
- Использовать специальные средства защиты;
- Быть готовым к эвакуации;
Взаимодействие водорода с кислородом может привести к образованию воды, однако оно сопровождается значительным выделением теплоты. Поэтому при обработке реагентами, содержащими водород, необходимо быть осторожными и предусмотреть возможность его безопасного удаления.
Вопрос-ответ

Каким образом можно получить водород с помощью реакции металлов и кислот?
Для получения водорода с помощью реакции металлов и кислот используются специальные химические реакции, например, реакция цинка с серной кислотой или реакция алюминия с соляной кислотой. В результате этих реакций образуется водородный газ, который можно собирать и использовать.
Какую роль играет металл в реакции получения водорода?
Металл играет роль восстановителя в реакции, то есть он отдает электроны, что позволяет протекать реакции окисления кислорода водородом. Реакция происходит по следующей схеме: металл отдаёт электроны, а кислород принимает эти электроны, образуя с водородом воду.
Какую роль играет кислота в реакции получения водорода?
Кислота в реакции получения водорода играет роль окислителя. Она принимает электроны, отдаваемые металлом, и сама в результате реакции превращается в другие вещества. В данном случае, серная кислота превращается в сернистый гидроген, а соляная кислота - в хлорид металла.
Какими металлами можно получить водород с помощью реакции с кислотами?
Для получения водорода с помощью реакции металлов и кислот можно использовать различные металлы. Например, цинк реагирует с серной кислотой, алюминий - с соляной кислотой. Однако не все металлы подходят для подобной реакции, так как некоторые из них не обладают достаточной активностью.
Для чего может быть использован полученный водород?
Полученный водород может быть использован в различных областях. Например, он может использоваться в качестве топлива для автомобилей с водородными топливными элементами, которые не выделяют вредных газов при сгорании. Водород также может быть использован в процессе водородации органических соединений или в качестве редукционного агента при химических реакциях.
