Металлы – это группа элементов, которые обладают уникальными свойствами, включающими возможность отдавать электроны. Это свойство делает металлы хорошими проводниками тока и тепла. Отдавая электроны, металлы играют важную роль во многих технологических процессах и имеют широкое применение в различных областях деятельности.
Способность металлов отдавать электроны связана с их электронной структурой. Внешний электронный уровень металла, называемый также валентным уровнем, содержит один или несколько электронов, которые слабо связаны с ядром атома. Именно эти электроны могут свободно передвигаться по кристаллической решетке металла и образовывать электронное облако.
Когда металл находится в контакте с другим телом, например, с другим металлом, электроны могут передаваться между ними. Этот процесс называется электронным переносом. При этом, часть электронов из валентного уровня металла отдаются другому телу, создавая электрический ток или электрохимическую реакцию.
Именно способность металлов отдавать электроны обуславливает их реакционную способность. Металлы имеют высокий уровень химической активности и могут взаимодействовать с другими веществами, вызывая различные химические реакции. Благодаря этим свойствам металлы нашли применение в производстве множества материалов и изделий.
Почему металлы отдают электроны?

Металлы отдают электроны из-за специфической структуры их атомов. В атоме металла нарушена симметрия зарядов, и часть электронов находится на свободных орбиталях. Эти свободные электроны, которые не привязаны к конкретным атомам, называются электронами проводимости.
Электроны проводимости обладают высокой подвижностью и могут свободно перемещаться по кристаллической решетке металла. При наличии потенциальной разницы (напряжения) между двумя точками металла электроны проводимости начинают двигаться в направлении более высокого потенциала.
Этот процесс передачи электронов от одного атома к другому называется электронной проводимостью. Основной фактор, определяющий способность металлов отдавать электроны, - низкая энергия ионизации. В связи с этим, у металлов относительно низкая энергия ионизации, что означает, что электроны легко отдаются и могут свободно перемещаться в структуре металла.
На практике, способность металлов отдавать электроны оказывает важное влияние на их электрические и тепловые свойства. Это позволяет использовать металлы в различных областях: от проводников электричества до материалов для теплового проводимости.
Механизм передачи электронов в металлах
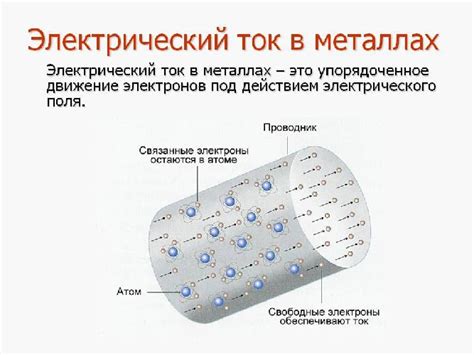
Металлы обладают важным свойством способности отдавать электроны. Это осуществляется через механизм передачи электронов, называемый электронным газом. В основе этого механизма лежит наличие свободных электронов в проводимости металла.
Свободные электроны в металле образуют электронный газ, заполняющий объем металла. Они могут свободно двигаться под действием внешнего электрического поля и переходить от одного атома к другому, образуя электрический ток.
Однако, чтобы свободные электроны могли передаваться между атомами, должна быть наличие энергетических уровней смежных атомов, называемых зонами. В металлах существуют две основные зоны – зона проводимости и зона запрещенных значений энергии.
Зона проводимости – это энергетический уровень, где находятся свободные электроны. Эти электроны находятся на достаточно высоких энергетических уровнях, которые позволяют им двигаться между атомами и участвовать в проводимости. Зона запрещенных значений энергии – это энергетический уровень, который разделяет зону проводимости от зоны запрещенных значений энергии для электронов, не связанных с атомами металла.
Общий результат этого механизма передачи электронов – образование электронного тока в металле. Этот механизм объясняет одну из основных свойств металлов – их способность проводить электричество.
Электронная структура металла
Одно из основных свойств металлов - это их способность отдавать электроны. Это связано с особенностями их электронной структуры.
Металлы обладают малым числом электронов на верхнем энергетическом уровне, что делает их внешние электроны слабо связанными с атомами. Это является ключевым фактором, обуславливающим способность металлов отдавать электроны.
Металлы характеризуются наличием свободных электронов, которые образуют так называемое "море электронов". Это море обеспечивает высокую проводимость и теплоотдачу в металлах. Свободные электроны могут свободно перемещаться внутри металлической решетки, образуя электронное облако.
Такая структура электронов позволяет металлам быть эффективными проводниками электричества и тепла. При подаче электрического или теплового потенциала, свободные электроны начинают двигаться в определенном направлении, обеспечивая электрический ток или передачу тепла.
Таким образом, электронная структура металла определяет его способность отдавать электроны и является основой для объяснения множества свойств и явлений, связанных с металлами.
Влияние размера атома на отдачу электронов
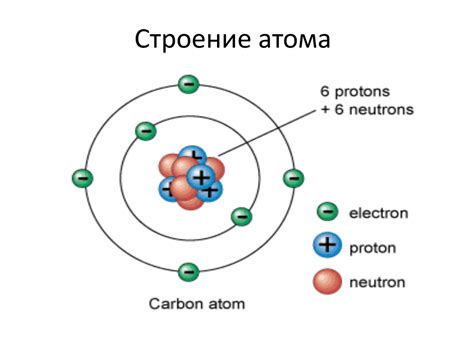
Свойство металлов отдавать электроны обусловлено строением и размерами атомов металла. Размер атома металла является важным фактором, влияющим на способность металла отдавать электроны. Металлы с меньшими атомами имеют большую электронную плотность, что позволяет им легче отдавать электроны.
Малый размер атома металла обусловлен высоким зарядом ядра и сильным притяжением электронов. Это приводит к тому, что электроны в металле находятся в более низких энергетических состояниях и могут быть легко отданы. Большой размер атома, наоборот, связан с низкой электронной плотностью и меньшей способностью металла отдавать электроны.
Существует закономерность влияния размера атома на его способность отдавать электроны. Чем меньше радиус атома металла, тем большей близостью энергетических уровней электронов он обладает. В результате, электроны более свободно перемещаются по металлической структуре и металл легче отдает электроны.
Эффект отдавания электронов зависит не только от размера атома, но и от его электронной конфигурации. Металлы с полностью заполненными энергетическими уровнями менее склонны к отдаче электронов, в то время как металлы с неполностью заполненными энергетическими уровнями легче отдают электроны.
Типы связей между атомами в металлах

Металлы обладают уникальными свойствами, включая способность отдавать электроны. Это свойство обусловлено типами связей между атомами в металлической структуре.
Одним из типов связей в металлах является металлическая связь. В этом типе связи электроны в металлической решетке делятся между всеми атомами. Они образуют своего рода "облако" электронов, которые свободно движутся внутри металла. Это позволяет металлам быть хорошими проводниками электричества и тепла, так как электроны могут легко передвигаться по решетке.
Еще одним типом связи между атомами в металлах является ионная связь. Она возникает, когда атомы металла отдают электроны и становятся положительно заряженными ионами. Эти ионы затем образуют кристаллическую структуру, в которой положительные ионы расположены в решетке, окружены облаком отдельных электронов. Ионная связь делает металлы твердыми и хрупкими, так как ионы притягиваются друг к другу сильными кулоновскими силами.
Также в металлах могут образовываться ковалентные связи. В этом случае атомы в металлической структуре обмениваются электронами, образуя пары или кластеры атомов. Эти кластеры затем образуют более сложные структуры, вызывающие определенные свойства вещества. Ковалентные связи могут придавать металлам особую прочность и твердость.
Эффекты изменения структуры на способность отдавать электроны

Способность металлов отдавать электроны определяется их структурой и свойствами электронной оболочки. Изменение структуры металла может привести к изменению этой способности.
Одним из факторов, влияющих на способность металла отдавать электроны, является размер ионов. Уменьшение размера иона может привести к увеличению эффективности отдачи электронов, так как уменьшается расстояние между ионом и валентными электронами.
Еще одним фактором, влияющим на способность металла отдавать электроны, является электронное строение. К примеру, металлы с полностью заполненными электронными оболочками имеют низкую способность отдавать электроны, так как у них нет свободных электронов для отдачи.
Кроме того, структура металла может быть модифицирована добавлением примесей. Некоторые примеси могут увеличить способность металла отдавать электроны, тогда как другие могут уменьшить эту способность. Это связано с изменением электронной структуры и влиянием примесей на образование свободных электронов.
Таким образом, изменение структуры металла может иметь существенное влияние на его способность отдавать электроны. Размер ионов, электронное строение и примеси могут все вместе определять эту способность и открывать новые возможности для использования металлов в различных областях технологии и науки.
Роль электронной свободы в процессе отдачи электронов

Способность металлов отдавать электроны является одним из их важных свойств. Это свойство связано с наличием у металлов свободных электронов, которые легко передвигаются внутри материала.
Объяснение данного явления лежит в особенностях строения атомов металлов. Атомы металлов обладают некоторой степенью электронной свободы, то есть электроны, находящиеся на внешних энергетических уровнях, слабо связаны с ядром атома. Эти свободные электроны не принадлежат ни к одному конкретному атому, а образуют своего рода "электронное облако", пронизывающее всю сущность металла.
Когда на металл действуют внешние факторы, например, электрическое поле, свободные электроны начинают двигаться в его направлении. Это объясняется тем, что электроны обладают отрицательным электрическим зарядом и тяготеют к положительно заряженным частицам. В результате, под действием электрического поля, электроны перемещаются от отрицательно заряженной части металла к положительно заряженной, что и обуславливает способность металла отдавать электроны.
Практическое применение свойства отдавать электроны в металлах

Способность металлов отдавать электроны является важным свойством, которое находит практическое применение в различных областях технологии и промышленности.
Одной из основных областей, где это свойство находит применение, является электротехника. Металлы с высокой проводимостью электричества, такие как медь и алюминий, используются для создания электрических контактов, проводов и кабелей. Благодаря способности этих металлов отдавать электроны, они обеспечивают эффективную передачу электрического тока.
Еще одним примером практического применения свойства отдавать электроны является электроника. Металлы, такие как серебро и золото, используются в производстве электронных компонентов, включая контакты, пайки и разъемы. Их способность отдавать электроны обеспечивает надежное и стабильное соединение, что особенно важно в микроэлектронике.
Благодаря способности металлов отдавать электроны, они также находят применение в производстве аккумуляторов и батарей. Металлические электроды, такие как цинк и свинец, способны отдавать электроны и участвуют в химических реакциях, позволяющих производить электрическую энергию.
Также следует отметить, что свойство металлов отдавать электроны влияет на их реактивность и химическую активность. Это свойство позволяет металлам участвовать в различных химических реакциях, включая окисление, восстановление и образование соединений с другими элементами. Благодаря этому металлы широко используются в производстве химических соединений, сплавов и различных материалов.
Вопрос-ответ

Что такое свойство металла "способность отдавать электроны"?
Свойство металла "способность отдавать электроны" означает, что металлы могут легко отдавать электроны из своей внешней оболочки атома.
Почему металлы обладают свойством "способность отдавать электроны"?
Металлы обладают свойством "способность отдавать электроны" из-за особенностей строения атомов металлов. У атомов металлов внешняя электронная оболочка слабо удерживает электроны, поэтому они могут легко покидать атом и становиться свободными электронами в металлической структуре.
