Фтор - химический элемент с атомным номером 9 и символом F. Он принадлежит к классу галогенов и является самым реактивным элементом в Периодической таблице. На самом деле, фтор намного более реактивен, чем обычная галогенная группа, включающая хлор, бром и йод.
Такая высокая активность фтора объясняется его электронной структурой. Фтор имеет семь электронов в своей внешней оболочке, недостающий всего один электрон для достижения стабильной октетной конфигурации. Это делает его очень склонным к реакции с другими элементами для получения этого недостающего электрона.
Фтор способен вступать в реакции со многими другими элементами, включая металлы, неметаллы и органические соединения. Он может образовывать сильные химические связи, что позволяет ему быть очень реактивным и мощным окислителем. Благодаря этим свойствам, фтор применяется во многих областях, включая производство химических соединений, электронику, стеклообработку и медицину.
Важно отметить, что фтор также известен своей высокой токсичностью. При работе с этим элементом необходимо соблюдать особую осторожность и принимать меры безопасности.
В заключение, фтор действительно является самым реактивным элементом в Периодической таблице. Его сильная активность и способность к образованию сильных химических связей делают его важным компонентом во многих химических и промышленных процессах. Тем не менее, использование фтора требует особой осторожности из-за его высокой токсичности.
Фтор - Самый Реактивный Элемент

Фтор – самый реактивный элемент в Периодической таблице. Его атомы обладают наибольшей электроотрицательностью и сильным наклоном к получению электронов от других элементов. Фтор имеет атомный номер 9 и химический символ F.
Фтор является газообразным элементом, который при обычных условиях образует связи только с другими элементами. Он обладает высокой реактивностью и может образовывать соединения с почти всеми элементами Периодической таблицы.
Фтор обладает сильными окислительными свойствами. Он может легко окислить другие элементы, особенно такие элементы, как водород, бериллий и углерод. Фтор также образует стабильные соединения с металлами, образуя ионные соединения, которые обладают высокой теплоустойчивостью.
Фтор является важным элементом в различных областях науки и промышленности. Он используется в производстве химических соединений, таких как фториды и хлорфторуглероды. Фтор также широко применяется в качестве реагента в химических реакциях и в процессе получения различных материалов.
Особенности реактивности фтора делают его полезным элементом во многих областях, но также представляют определенные вызовы в обращении с этим веществом. Из-за своей реактивности и высокой токсичности, фтор нужно использовать с особым вниманием и предосторожностью.
Свойства Фтора

Фтор (F) является самым реактивным элементом в Периодической таблице. Он относится к галогенам и обладает рядом уникальных свойств.
1. Агрессивность и реакционность: Фтор является очень агрессивным химическим элементом, способным образовывать соединения с практически всеми остальными элементами. Он реагирует с металлами, неметаллами и даже с некоторыми инертными газами. Фтор может привести к серьезным ожогам и отравлению при контакте с кожей или вдыхании его паров.
2. Сильный окислитель: Фтор является одним из самых сильных окислителей. Он способен окислять многие вещества и образовывать стабильные и высокоэнергетические соединения. Эту способность фтора часто используют в промышленности для получения различных химических соединений.
3. Высокая электроотрицательность: Фтор является самым электроотрицательным из всех элементов. Это значит, что он сильно притягивает электроны в химических связях. Благодаря этому свойству, фтор образует очень крепкие и устойчивые химические связи.
4. Состояние элементарного фтора: При обычных условиях фтор существует в виде желтого газа, обладающего неприятным запахом. Этот элемент очень ядовит и его пары обладают раздражающим действием на слизистую оболочку глаз и дыхательных путей.
5. Важное применение: Фтор имеет широкое применение в различных областях. Он используется в производстве стекла, алюминия, фторопластов и многих других полимеров. Кроме того, он является ключевым компонентом многих зубных паст и применяется в качестве химического агента в водных системах для превращения вредных ионов в безопасные соединения.
Химическая Активность Фтора

Фтор является самым реактивным элементом в Периодической таблице. Он обладает высокой электроотрицательностью и стремится к электронному октету, что делает его очень активным химическим веществом.
Фтор образует соединения с большинством элементов, включая металлы, неметаллы и полупроводники. Он реагирует с водородом, образуя галогениды водорода, такие как фторид водорода. Фтор также реагирует с металлами, образуя фториды металлов. Некоторые из этих фторидов являются очень стабильными и трудно разлагаемыми соединениями.
Фтор реагирует с кислородом, образуя кислородные фториды, такие как фторид кислорода. Эти соединения обладают высокой энергией и используются в качестве окислителей в различных процессах, включая ракетную промышленность.
Фтор также образует соединения с другими неметаллами, такими как хлор, бром и йод. Образование таких галогенидов приводит к образованию различных трифторидов, тетрафторидов и пентафторидов, которые широко используются в органическом синтезе и промышленных процессах.
Кроме того, фтор является элементом, который может заменять другие атомы в молекулах органических соединений. Фторирование органических соединений может улучшить их свойства, такие как устойчивость к теплу и химической коррозии.
Таким образом, химическая активность фтора обусловлена его высокой электроотрицательностью и способностью к образованию стабильных соединений с другими элементами. Это делает его одним из наиболее важных элементов в химии и промышленности.
Взаимодействие Фтора с другими элементами
Фтор - самый реактивный элемент в Периодической таблице, благодаря своей высокой электроотрицательности. Это позволяет ему проявлять активность взаимодействия с другими элементами.
Фтор образует со многими элементами ковалентные и ионные связи. С другими неметаллами он реагирует, образуя с ними соединения, такие как фториды, например, фториды водорода, кислорода, серы и многих других.
Фтор также проявляет активность взаимодействия с щелочными металлами, например, натрием и калием, образуя ионные соединения - фториды. Фториды натрия и калия широко используются в промышленности и научных исследованиях.
Взаимодействие фтора с щелочноземельными металлами, такими как магний, кальций и барий, приводит к образованию соединений, таких как фториды, фосфаты и сульфаты. Эти соединения находят применение в различных отраслях промышленности.
С тяжелыми металлами фтор также взаимодействует, образуя соединения, такие как хлориды, бромиды и йодиды. Взаимодействие фтора с тяжелыми металлами обычно более сильное, чем с щелочными металлами, из-за высокой электроотрицательности фтора.
Важность Фтора в промышленности
Фтор является одним из самых важных элементов в промышленности благодаря своей высокой химической активности. Он широко используется в различных отраслях, включая производство химических продуктов, электронику, стекло и металлургию.
Одним из главных применений фтора является его использование в производстве химических реагентов. Фторсодержащие соединения, такие как газообразный фторид водорода, используются в качестве катализаторов и агентов фторирования в различных химических процессах. Они играют важную роль в синтезе лекарственных препаратов, пластиков, красителей и других химических веществ.
Фтор также находит широкое применение в электронной промышленности. Он является ключевым компонентом в производстве полупроводников и изоляционных материалов. Фторсодержащие полимеры и резины применяются для создания изоляции проводов и кабелей, а также для производства электронных компонентов, таких как чипы и печатные платы.
Значительную роль фтор играет в производстве стекла. Фторсодержащие соединения применяются для повышения прочности и стекловидности материалов, а также для создания специальных стекол с определенными оптическими свойствами. Фторид кальция, например, используется в производстве оптических приборов, линз и оптических волокон.
Металлургия также не обходится без фтора. Он применяется для очистки металлов от примесей и окислов, а также для получения сплавов с улучшенными механическими свойствами. Фторид алюминия используется для производства алюминия, который широко применяется в авиации, строительстве и производстве упаковочных материалов.
Таким образом, фтор играет важную роль в промышленности, обеспечивая высокую эффективность и улучшение свойств различных материалов и продуктов. Его химическая активность и уникальные свойства делают его одним из самых необходимых и востребованных элементов в современной промышленности.
Применение Фтора в медицине и в быту
Фтор – один из самых реактивных элементов в Периодической таблице. Благодаря своим химическим свойствам, Фтор нашёл широкое применение в медицине и быту. За счет своей химической активности и антимикробного действия, Фтор является неотъемлемой составляющей многих медицинских препаратов и процедур.
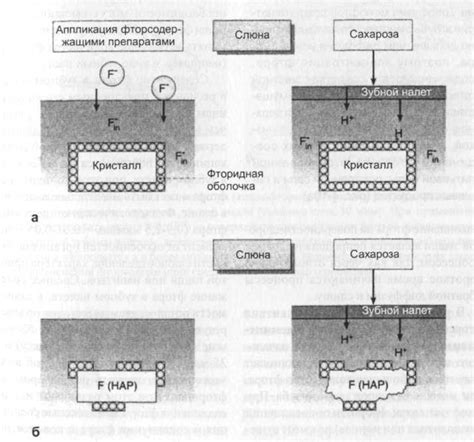
Одним из наиболее распространенных применений Фтора в медицине является его использование в стоматологии. Фторид натрия и фторид кальция применяются для профилактики кариеса и укрепления эмали зубов. Это достигается благодаря формированию стойкого соединения с кальцием, что способствует препятствию разрушению эмали и образованию кариеса.
Фтор также используется в процессе производства антибактериальных и противогрибковых лекарств. Его способность уничтожать микроорганизмы делает его ценным компонентом для борьбы с инфекциями. Например, один из самых широко применяемых антибиотиков – фторхинолоновая группа, содержит Фтор в своей структуре, что придает им высокую активность в борьбе с бактериями.
В быту Фтор имеет целый ряд полезных свойств и применений. Фторированная вода является общепризнанным средством для защиты зубов от кариеса. Фторированные зубные пасты и маски обеспечивают более эффективную профилактику заболеваний полости рта. Кроме того, Фтор применяется при производстве многих бытовых товаров, таких как мыло, моющие средства и дезинфицирующие средства, благодаря своим антисептическим свойствам.
Таким образом, Фтор, будучи самым реактивным элементом в Периодической таблице, нашел широкое применение в медицине и быту. Создание препаратов и процедур, основанных на химических свойствах Фтора, позволяет эффективно бороться с заболеваниями и инфекциями, а также обеспечивать надежную защиту зубов от разрушения.
Вопрос-ответ

Чем обусловлена самореакция фтора?
Самореакция фтора обусловлена его высокой электроотрицательностью и малым радиусом. Фтор - сильный окислитель и ионизирующий агент, способный реагировать с большинством элементов и соединений.
Почему фтор образует соединения с большинством элементов в Периодической таблице?
Фтор образует соединения с большинством элементов в Периодической таблице из-за его высокой электроотрицательности. Он стремится украсть электроны у других элементов, чтобы достичь стабильной октетной конфигурации.
Какие реакции фтора наиболее известны?
Наиболее известными реакциями фтора являются его реакции с металлами, галогенами и некоторыми органическими соединениями. Фтор может образовывать соединения с металлами, такие как натрий и алюминий, а также может вступать в реакцию с другими галогенами, образуя галогениды.
Какие опасности сопряжены с использованием фтора?
Использование фтора сопряжено с опасностями из-за его высокой реактивности. Фтор может быть ядовитым и вызывать ожоги, реакции с кожей и дыхательными путями. Кроме того, фтор может вызывать разрушение материалов, таких как стекло и металлы.
В чем состоит основное применение фтора?
Фтор имеет широкое применение в различных областях. Он используется в производстве алюминия, пластмасс, электроники и лекарств. Фтор также используется в производстве химических соединений, таких как фреоны и фториды, которые находят применение в холодильниках, огнетушителях и других промышленных процессах.
