Щелочные металлы представляют собой группу элементов в таблице Менделеева, которые включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они расположены в первой группе периодической системы и известны своей высокой химической активностью.
Одним из характерных свойств щелочных металлов является низкая плотность. Например, литий - самый легкий из всех металлов и встречается в виде плавающих воздушных шаров. Также щелочные металлы обладают низким плавлением и кипением, что делает их идеальными для использования в высокотемпературных приложениях.
Еще одним важным свойством щелочных металлов является их реакционность с водой. Каждый из них, кроме лития, реагирует с водой, образуя щелочное гидроксидное растворение и выделяя гидроген газ. Эта реакция является сильно взрывоопасной и, следовательно, требует осторожного обращения с щелочными металлами.
В целом, свойства щелочных металлов делают их важными элементами в нашей жизни, применяются в различных областях, включая химическую промышленность, энергетику и медицину.
Таким образом, знание свойств щелочных металлов в таблице Менделеева играет важную роль в изучении и понимании химических процессов, происходящих в природе и промышленности.
Физические свойства щелочных металлов

Щелочные металлы являются группой элементов, расположенных в первой группе периодической таблицы Менделеева. Они включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Щелочные металлы имеют ряд общих физических свойств, обусловленных их электронной структурой и межатомными взаимодействиями.
Низкая плотность: Щелочные металлы обладают низкой плотностью, что означает, что они легкие и легко раздавливаются. Наиболее легкий из них - литий - имеет плотность всего 0,53 г/см³, тогда как калий и цезий имеют плотность около 0,85 г/см³.
Мягкость и пластичность: Все щелочные металлы являются мягкими и пластичными. Они могут легко быть рассечены ножом или превращены в проволоку. Натрий и калий настолько мягкие, что могут быть рассечены ножом без особых усилий.
Низкое температура плавления: Щелочные металлы имеют низкие температуры плавления. Например, литий плавится при температуре всего 180 °C, а калий - при 63 °C. Это делает их применимыми в различных технологиях и процессах, связанных с низкими температурами.
Высокая теплопроводность: Щелочные металлы обладают высокой теплопроводностью, что означает, что они хорошо передают тепло. Их атомы располагаются близко друг к другу, позволяя электронам передвигаться легче и быстрее. Это свойство делает щелочные металлы полезными в теплообменных устройствах и системах охлаждения.
Химическая реактивность: Щелочные металлы сильно реактивны и реагируют с водой, кислородом и многими другими веществами. Когда они контактируют с водой, образуется газ водород. Они также могут образовывать соли с различными кислотами и диссоциировать в ионы в растворах.
В целом, физические свойства щелочных металлов определяют их использование в различных областях науки, промышленности и технологий. Они широко применяются в производстве щелочных батарей, стекла, легких сплавов и многих других материалов и продуктов.
Химические свойства щелочных металлов

Щелочные металлы - группа элементов I группы периодической системы Д.И. Менделеева, к которой относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). У них есть ряд общих химических свойств, характерных для металлов.
Первое заметное свойство щелочных металлов - их мягкость. Они мягче других металлов и могут быть разрезаны ножом. Кроме того, они обладают низкой плотностью, что делает их легкими и легкоплавкими элементами.
Щелочные металлы активно реагируют с водой, образуя щелочи и выделяя водород. Это происходит из-за высокой реакционной способности этих элементов, вызванной их низкой ионизацией энергии и большим радиусом иона.
Другой важной характеристикой щелочных металлов есть их способность образовывать катионы. Они легко теряют свой внешний электрон и образуют положительно заряженные ионы. Это делает их хорошими источниками электронов, которые могут быть использованы в химических реакциях.
Щелочные металлы также образуют сольные соединения, реагируя с кислотами. Они могут образовывать различные соли, которые могут иметь разнообразные цвета и свойства.
Кроме того, щелочные металлы обладают хорошей проводимостью электричества и тепла, что делает их полезными в различных технологических процессах и электронике.
В целом, щелочные металлы обладают уникальными химическими свойствами, которые делают их важными элементами для многих областей науки и технологий.
Реактивность щелочных металлов
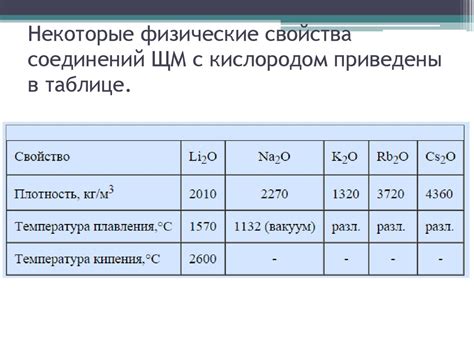
Щелочные металлы - это элементы первой группы таблицы Менделеева, включающие литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти металлы характеризуются высокой реактивностью и способностью активно вступать в химические реакции.
Наиболее реактивным щелочным металлом является франций, который обладает самой низкой ионизационной энергией в группе. Он легко реагирует с кислородом, халогенами и водой, образуя соответствующие оксиды, галогениды и гидроксиды.
Следующий по реактивности щелочный металл - цезий. Он также обладает низкой ионизационной энергией и может активно взаимодействовать с водой, образуя водород и гидроксид цезия.
Калий и рубидий также реагируют с водой, образуя соответствующие гидроксиды и водород. Однако они менее реактивны, чем франций и цезий.
Самым малореактивным из щелочных металлов является литий. Он образует стабильные оксиды и гидроксиды, и реагирует только с кислородом при высоких температурах.
Реактивность щелочных металлов обусловлена их электрохимическими свойствами. Они имеют один валентный электрон во внешней оболочке, что делает их склонными к потере этого электрона при реакциях. Получив положительный заряд, они образуют ионы, которые активно взаимодействуют с другими веществами.
Взаимодействие щелочных металлов с водой

Щелочные металлы, такие как литий, натрий, калий и др., обладают способностью активно взаимодействовать с водой. Это свойство обусловлено их химической структурой и электрохимическими свойствами.
При взаимодействии с водой щелочные металлы выделяются водородный газ и образуют гидроксиды. Реакция протекает очень быстро и сопровождается выделением тепла и пламени. Все щелочные металлы проявляют подобное поведение, но различаются интенсивностью реакции.
Литий, наименьший из щелочных металлов, имеет наиболее сильное взаимодействие с водой. Однако, в отличие от других щелочных металлов, литийной реакцией не сопровождается пламя. Натрий и калий реагируют с водой достаточно активно и образуют щелочные гидроксиды.
При взаимодействии с водой происходит образование водорода, который поднимается вверх и может зажигаться от образовавшегося при реакции пламени. Это связано с тем, что водород является легким газом и обладает способностью гореть на воздухе. Пламя при взаимодействии щелочных металлов с водой может иметь различную яркость и цвет.
Создание щелочноземельных соединений

Щелочноземельные соединения – это химические соединения, получаемые путем реакции щелочноземельных металлов с другими элементами или соединениями. Щелочноземельные металлы, такие как бериллий, магний, кальций, стронций, барий и радий, обладают свойствами, которые позволяют им образовывать разнообразные соединения.
В химической промышленности широко используются щелочноземельные соединения для производства различных материалов. Например, оксиды щелочноземельных металлов активно применяются в качестве катализаторов, а также для производства стекла, эмали, керамики и других материалов.
Одно из наиболее распространенных способов получения щелочноземельных соединений – реакция металлов с кислотами. При этом образуются соли щелочноземельных металлов и вода. Например, реакция кальция с серной кислотой приводит к образованию соли – сульфата кальция и выделению воды.
Другим способом получения щелочноземельных соединений является реакция металлов с галогенами. При этом образуются галогениды щелочноземельных металлов, такие как хлориды, бромиды и йодиды. Например, реакция магния с хлором приводит к образованию хлорида магния.
Также возможно получение щелочноземельных соединений при действии металлов на оксиды других элементов. При этом образуются оксиды щелочноземельных металлов и соли. Например, реакция бериллия с оксидом алюминия приводит к образованию алюминатов бериллия и выделению магния.
Применение щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют широкое применение в различных отраслях промышленности благодаря своим уникальным физическим и химическим свойствам.
Одним из основных применений щелочных металлов является производство щелочей и щелочных растворов. Щелочи, такие как гидроксид натрия (NaOH) и гидроксид калия (KOH), широко используются в текстильной, стекольной, пищевой и многих других отраслях промышленности.
В процессе электролиза используются сплавы, содержащие щелочные металлы. Натрий и калий являются ключевыми компонентами электролитов, используемых в аккумуляторах. Эти элементы обладают высокой электропроводностью и представляют собой важный элемент в производстве современных аккумуляторных систем.
Еще одним интересным применением щелочных металлов является их использование в фармацевтической промышленности. Литий, например, используется для производства лекарственных препаратов, применяемых при биполярных расстройствах и депрессии.
Щелочные металлы также используются в производстве стекла и керамики. Калий и натрий являются ключевыми ингредиентами для создания различных видов стекла, который широко применяется в строительстве, автомобильной, оптической и электронной промышленности.
Кроме того, щелочные металлы используются в промышленности для создания легких сплавов, которые обладают высокой прочностью и хорошими свойствами для обработки. Цезий и рубидий широко применяются в приборостроении и электронной технике для создания полупроводниковых приборов и лазеров.
В заключение, щелочные металлы играют важную роль в промышленности благодаря своим уникальным свойствам. Их применение в производстве щелочей, аккумуляторных систем, фармацевтической промышленности, стекла, керамики и сплавов делает их неотъемлемой частью современных технологий и жизни.
Вопрос-ответ

Какие свойства щелочных металлов можно найти в таблице Менделеева?
В таблице Менделеева можно найти следующие свойства щелочных металлов: атомный номер, символ элемента, относительную атомную массу, электронную конфигурацию, валентность, период и группу, радиус атома, электроотрицательность, плотность, температуру плавления и кипения, а также другие физические и химические свойства.
Какие щелочные металлы присутствуют в таблице Менделеева?
В таблице Менделеева присутствуют все шесть щелочных металлов: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие свойства щелочных металлов влияют на их реакцию с водой?
Свойства щелочных металлов, такие как малая электроотрицательность, низкая ионизационная энергия и низкая энергия атома при окислении, делают их очень реактивными с водой. Они реагируют с водой, высвобождая водород и образуя гидроксиды щелочных металлов. Процесс реакции с водой усиливает положение щелочного металла в ряду активности металлов.
Какие свойства щелочных металлов делают их популярными в различных областях науки и технологии?
Щелочные металлы обладают рядом полезных свойств, что делает их популярными в различных областях науки и технологии. Например, литий используется в производстве литий-ионных аккумуляторов, калий - в удобрениях, натрий - как реагент в химической промышленности, рубидий - в лазерной технологии, цезий - в атомных часах и других высокоточных приборах.
Какие свойства щелочных металлов необходимы для их использования в медицине?
Щелочные металлы имеют несколько свойств, которые делают их полезными в медицине. Например, натрий используется в медицинском оборудовании для поддержания pH уровня крови пациента. Калий и литий также играют роль в поддержании кислотно-щелочного баланса организма. Кроме того, литий используется для лечения психических расстройств, таких как биполярное расстройство.
