Металлы являются одними из наиболее распространенных элементов в природе. Их особенностью является способность вступать во взаимодействие с различными веществами и соединениями, такими как кислород, вода, кислоты и щелочи. Реакции металлов с этими веществами могут приводить к различным химическим превращениям и образованию новых соединений.
Один из наиболее известных примеров взаимодействия металлов - это окисление, то есть реакция с кислородом. Многие металлы, такие как железо, алюминий и магний, активно реагируют с кислородом воздуха, образуя оксиды. Например, железо при окислении образует ржавчину, а алюминий - оксид алюминия. Эти реакции могут привести к разрушению металлических конструкций и повреждению поверхности металлов.
Металлы также могут взаимодействовать с другими химическими веществами, например, с водой. Некоторые металлы, такие как натрий и калий, реагируют с водой с выделением горючих газов и образованием гидроксидов. Эти реакции могут быть очень быстрыми и сопровождаются выделением большого количества энергии.
Кроме того, металлы могут взаимодействовать с кислотами и щелочами. Например, цинк активно реагирует с соляной кислотой, образуя соли и выделяя водород. Алюминий реагирует с щелочами, такими как натрий или калий гидроксиды, образуя соли и выделяя гидроген. Эти реакции широко используются в химической промышленности для получения различных соединений и материалов.
Реакции металлов с веществами могут быть очень разнообразными и включать образование оксидов, гидроксидов, солей и выделение газов. Изучение этих реакций имеет важное практическое значение и позволяет создавать новые материалы и технологии.
Реакции металлов: список соединений, с которыми они взаимодействуют
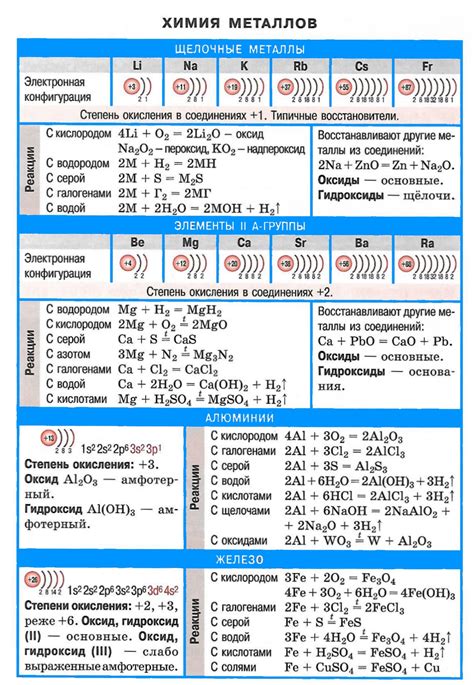
Металлы являются химическими элементами, которые обладают способностью взаимодействовать с различными соединениями. Взаимодействие металлов с другими веществами может приводить к образованию различных реакционных продуктов.
Одним из наиболее известных типов реакций металлов является их взаимодействие с кислородом. Некоторые металлы, например, железо, алюминий, медь и цинк, окисляются при взаимодействии с кислородом, образуя оксиды. Например, железо окисляется до образования оксида железа (Fe2O3), а алюминий – до образования оксида алюминия (Al2O3).
Кроме взаимодействия с кислородом, металлы также могут реагировать с другими реагентами. Например, они могут реагировать с кислотами, образуя соли и выделяя водород. Так, натрий при взаимодействии с соляной кислотой образует хлорид натрия и выделяет водородный газ (2Na + 2HCl → 2NaCl + H2).
Взаимодействие металлов с водой также является частой реакцией. Некоторые металлы, например, натрий и калий, реагируют с водой, образуя основания и выделяя водород (2Na + 2H2O → 2NaOH + H2). В то же время некоторые металлы, например, железо и алюминий, не реагируют с водой при комнатной температуре, но способны реагировать с горячей паровой водой или сильными щелочами.
Кроме того, металлы могут реагировать с различными соединениями, такими как кислоты, основания, соли, галогены и другие органические и неорганические вещества. Например, алюминий может образовывать реакции с кислотами, основаниями, галогенами и аммиаком, образуя соответствующие соли.
В общем, реакции металлов с различными соединениями позволяют получить широкий спектр продуктов, которые могут иметь различные физические и химические свойства. Это делает металлы важными и полезными материалами в различных отраслях промышленности и науки.
Кислород

Кислород – это реактивный газ, обладающий высокой активностью и природным состоянием входящий в состав воздуха нашей планеты. Он является одним из основных реагентов для множества химических реакций. Взаимодействие с кислородом можно наблюдать у большинства металлов, которые природным образом встречаются на земле.
Кислородным взаимодействием с металлами характеризуются различные процессы окисления и образования оксидов. Причиной этого является стремление металлов совместить свои электроны с электронами кислорода, образуя ионы и соединения с оксигеном. Такие реакции химически протекают при высоких температурах или в условиях активного окислительного окружения.
Однако не все металлы одинаково активно взаимодействуют с кислородом. Некоторые из них обладают высокой степенью реакционности и образуют стабильные соединения, например, щелочные и щелочноземельные металлы, такие как натрий, калий, магний и кальций. Другие же, например, платина или золото, менее активны и реагируют с кислородом только при очень высоких температурах или при наличии активных катализаторов.
Взаимодействие металлов с кислородом имеет широкое практическое применение. Например, ржавеющие металлы, такие как железо и сталь, окисляются при длительном воздействии кислорода, что приводит к образованию окисных пленок на их поверхности и ухудшению свойств материала. С другой стороны, кислород используется в процессах сжигания металлов для получения энергии, например, при горении топлива внутреннего сгорания.
Вода

Вода - один из наиболее распространенных и известных веществ, с которым взаимодействуют различные металлы. Вода состоит из молекул, каждая из которых содержит одну кислородную и две водородные атомы.
Ряд металлов взаимодействует с водой очень активно. К ним относятся щелочные и щелочноземельные металлы, такие как литий (Li), натрий (Na), калий (K), магний (Mg) и кальций (Ca). Взаимодействие этих металлов с водой происходит с выделением водорода и образованием гидроксидов металлов. Например, металл натрий реагирует с водой с образованием гидроксида натрия и выделением водорода:
2Na + 2H2O -> 2NaOH + H2
Некоторые металлы, такие как железо (Fe), алюминий (Al) и цинк (Zn), сравнительно пассивны в отношении воды. Они не реагируют с водой в обычных условиях, однако сильное нагревание может активировать их взаимодействие с водой.
Также вода может вызывать коррозию и разрушение металлов. Например, никель (Ni) и железо (Fe) могут подвергаться ржавлению при длительном контакте с водой, особенно в условиях наличия кислорода и солей. Вода может являться средой, способствующей коррозии и окислению металлов.
Кислоты
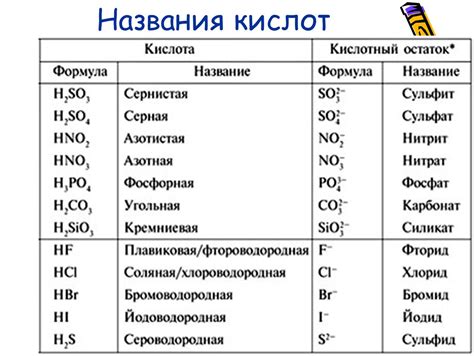
Металлы могут взаимодействовать с различными кислотами. Кислоты представляют собой химические соединения, способные выделять положительно заряженные ионы в растворе. Взаимодействие металлов с кислотами может быть различным и зависит от их химических свойств.
Некоторые металлы, такие как алюминий и цинк, реагируют с кислотами, выделяя водород. Например, алюминий взаимодействует с соляной кислотой, образуя хлорид алюминия и выделяя водород.
Другие металлы, такие как железо и свинец, не реагируют с обычными кислотами, такими как соляная или уксусная кислоты. Однако они могут реагировать с более сильными кислотами, например, с концентрированной соляной кислотой или азотной кислотой.
Некоторые высокореактивные металлы, такие как натрий и калий, реагируют с водой, образуя щелочь и выделяя водород. Это не является прямой реакцией с кислотами, но также относится к их взаимодействию с веществами, способными выделять ионы.
Кислоты могут быть использованы для очистки металлических поверхностей от окиси и других загрязнений. Они могут также быть использованы в химической промышленности для получения различных металлических соединений.
Щелочи

Щелочи, или щелочные металлы, – это группа химических элементов, которые взаимодействуют с водой, образуя щелочные растворы. В таблице Менделеева эти элементы расположены в первой группе и включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Щелочные металлы реагируют с водой, выделяя водородный газ и образуя гидроксиды – щелочи. Реакция с водой происходит очень быстро и сопровождается выделением большого количества тепла. Гидроксиды щелочных металлов обладают щелочными свойствами и широко используются в различных областях химии и технологии.
Щелочные растворы обладают такими свойствами, как щелочность, густота, прозрачность, носят щелочной привкус и обладают специфическим запахом. Они реагируют с кислотами, образуя соли и воду. Также щелочные растворы растворяют многие металлы, осуществляя процессы окисления.
В промышленности щелочи используются для производства мыла, бумаги, текстиля и других химических продуктов. В медицине они применяются в качестве антацидных препаратов и в составе бафферных растворов. Они также используются в лаборатории для поддержания и регулирования pH растворов.
Соляная кислота

Соляная кислота (также известная как хлоридная кислота) — одна из самых распространенных и сильных минеральных кислот. Она широко используется в промышленности и лаборатории благодаря своим химическим свойствам и высокой реакционной способности.
Соляная кислота обладает едким запахом и является жидкостью без цвета, прозрачной в чистом состоянии. Она является кислотой сильного характера и образует ионы водорода (H+) при растворении в воде. Это позволяет ей быстро реагировать с различными веществами и материалами, в том числе с металлами.
Реакция с металлами:
- Соляная кислота реагирует с активными металлами, такими как натрий (Na), калий (K) и магний (Mg), образуя соли и высвобождая водородный газ (H2). Реакция происходит при образовании эффервесценции и выделении тепла.
- Взаимодействие с некоторыми менее активными металлами, такими как алюминий (Al), железо (Fe) и цинк (Zn), происходит со сходными результатами. Соляная кислота разлагает их, образуя соли и выделяя гидроген.
Соляная кислота обладает агрессивными свойствами, поэтому требуется осторожность при ее использовании. Она может вызывать раздражение кожи, слизистых оболочек и дыхательных путей. При работе с соляной кислотой необходимо соблюдать меры предосторожности и использовать защитное оборудование, как например, защитные очки и перчатки.
Растворы металлических солей

Растворы металлических солей представляют собой водные растворы, содержащие соединения металлов с кислотами или другими анионами. Эти растворы могут быть использованы в различных областях, таких как химическая промышленность, медицина и сельское хозяйство.
Металлические соли обладают рядом характеристик, которые делают их важными веществами для различных процессов. Например, они могут обладать антисептическими свойствами, быть катализаторами или использоваться в процессах окисления и восстановления.
Растворы металлических солей также широко применяются в аналитической химии. Они используются для определения концентрации различных веществ, а также для проведения качественных и количественных анализов.
- Одним из примеров растворов металлических солей являются растворы солей меди. Они могут быть использованы для получения различных оттенков голубого цвета при окрашивании материалов, таких как керамика и стекло.
- Растворы солей железа используются в медицине в качестве источника железа для организма, особенно при лечении анемии. Они также широко применяются в сельском хозяйстве для удобрения почвы.
- Растворы солей цинка имеют антисептические свойства и используются для лечения различных кожных заболеваний. Они также могут быть использованы для профилактики коррозии металлических поверхностей.
Таким образом, растворы металлических солей играют важную роль в самых различных областях нашей жизни, от промышленности до медицины. Их свойства и состав позволяют использовать их для различных нужд, и поэтому они заслуживают внимания и изучения.
Органические соединения
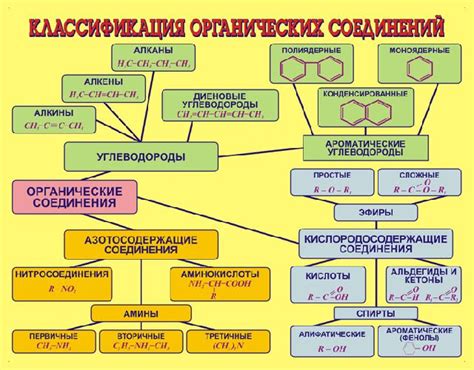
Органические соединения - это химические соединения, которые содержат углерод в своей структуре. Металлы могут взаимодействовать с некоторыми органическими соединениями, образуя различные реакции и соединения.
Органические кислоты являются одним из классов органических соединений, с которыми металлы могут взаимодействовать. Например, некоторые металлы, такие как алюминий или натрий, реагируют с карбоновыми кислотами, образуя соли и высвобождая водород. Эта реакция широко используется в органическом синтезе и в процессе производства препаратов.
Амины, класс соединений, содержащих азот, также могут вступать в реакцию с металлами. Некоторые металлы, такие как медь или никель, могут образовывать комплексные соединения с аминами, которые могут быть использованы в качестве катализаторов или в процессе изготовления полимеров.
Органические алкоголи также могут быть подвержены взаимодействию с металлами. Например, некоторые металлы, такие как калий или натрий, могут реагировать с алкоголями, образуя соли и высвобождая водород. Эта реакция может быть использована для получения различных органических соединений и в процессе производства лекарственных препаратов.
Органические эфиры - это еще один класс органических соединений, которые могут взаимодействовать с металлами. Некоторые металлы, такие как литий или магний, могут реагировать с эфирами, образуя комплексные соединения. Эта реакция может быть использована для получения определенных органических соединений и в процессе синтеза новых материалов.
Вопрос-ответ

С какими веществами металлы могут взаимодействовать?
Металлы могут взаимодействовать с кислородом, водой, кислотами, щелочами и другими металлами.
Как металлы взаимодействуют с кислородом?
Металлы могут реагировать с кислородом, образуя оксиды. Некоторые металлы окисляются при контакте с кислородом воздуха и покрываются слоем оксида.
Что происходит при взаимодействии металлов с кислородом?
При взаимодействии металлов с кислородом образуются оксиды металлов. Например, железо реагирует с кислородом, образуя оксид железа (III).
Какие вещества могут вызывать реакцию с металлами?
Металлы могут взаимодействовать с кислотами, щелочами, солями, водой и другими металлами. Например, некоторые металлы реагируют с кислотами, выделяя водородный газ.
