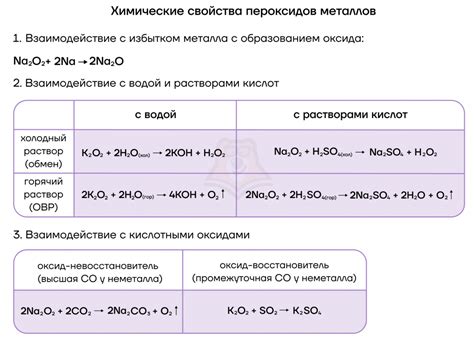
Пероксиды щелочных металлов представляют собой химические соединения, содержащие в своей структуре анионный радикал пероксид-ион О₂²⁻. Они обладают значительными окислительными свойствами и широко применяются в различных отраслях промышленности.
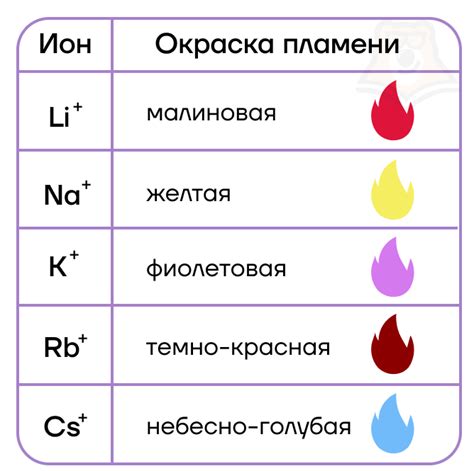
Список пероксидов щелочных металлов включает такие соединения, как пероксид натрия (Na₂O₂), пероксид калия (K₂O₂), пероксид лития (Li₂O₂), пероксид рубидия (Rb₂O₂) и пероксид цезия (Cs₂O₂). Они обладают схожей структурой и свойствами, но некоторые из них имеют некоторые особенности, которые делают их более привлекательными для определенных применений.
Пероксид натрия является наиболее широко используемым пероксидом щелочного металла. Он применяется в качестве кислородосодержащего и окислительного агента, а также в производстве белковых и жирных кислот, целлюлозы и многих других продуктов. Кроме того, пероксид натрия используется в качестве осветлителя и отбеливателя в текстильной и бумажной промышленности.
Пероксиды щелочных металлов играют важную роль в различных отраслях промышленности и науки. Они обладают большим потенциалом для разработки новых технологий и процессов, что делает их объектом постоянного исследования и усовершенствования.
Пероксиды щелочных металлов: список и основные свойства
Пероксиды щелочных металлов представляют собой химические соединения, содержащие пероксидный ион O2^2-. В основном, пероксиды щелочных металлов получают путем реакции щелочного металла с кислородом или водным раствором пероксида в присутствии воды. В результате образуется соединение с ярко выраженной окраской, воздухонепроницаемое и нестабильное.
В список пероксидов щелочных металлов входят следующие соединения:
- Пероксид лития (Li2O2)
- Пероксид натрия (Na2O2)
- Пероксид калия (K2O2)
- Пероксид рубидия (Rb2O2)
- Пероксид цезия (Cs2O2)
Основными свойствами пероксидов щелочных металлов являются:
- Ярко-желтая или коричневая окраска, вызванная поглощением света в видимом диапазоне.
- Высокая химическая активность, особенно при контакте с водой.
- Способность выделять кислород при разложении, что делает их эффективными окислителями.
- Образование перекисей, когда пероксиды вступают в реакцию с кислотами.
- Нестабильность при хранении и транспортировке из-за высокой реакционной способности.
Таким образом, пероксиды щелочных металлов представляют собой важный класс соединений, используемых в химической промышленности и лабораторных исследованиях. Их уникальные свойства делают их полезными как окислителями и катализаторами в различных реакциях.
Пероксиды щелочных металлов и их химическая природа
Пероксиды щелочных металлов являются соединениями, в которых металл связан с двумя атомами кислорода. Эти соединения характеризуются высокой степенью окислительности, поскольку кислород в пероксидах обладает -1 зарядом. Существуют пероксиды лития, натрия, калия, рубидия и цезия.
Пероксиды щелочных металлов обычно представляют собой белые кристаллы или порошки. Они хорошо растворяются в воде, образуя щелочные растворы. Взаимодействие пероксидов щелочных металлов с водой протекает с выделением кислорода. Это свойство позволяет использовать пероксиды щелочных металлов как источники кислорода в различных химических процессах.
Пероксиды щелочных металлов обладают высокой реакционной способностью. Они могут вступать в реакцию с органическими и неорганическими веществами, образуя различные продукты. Например, пероксид натрия можно использовать для окисления органических соединений в процессе синтеза лекарств или красителей.
Однако пероксиды щелочных металлов также являются сильными окислителями и могут представлять опасность при неправильном обращении. Они могут вызывать химические ожоги и взрывоопасность при соприкосновении с органическими веществами или горючими материалами. Поэтому пероксиды щелочных металлов требуют особого внимания и правил безопасного хранения и использования.
Основные свойства пероксидов щелочных металлов

Пероксиды щелочных металлов являются соединениями, содержащими атомы щелочных металлов и пероксидные группы O2-. Они обладают рядом характерных свойств, которые определяют их особую роль в химических реакциях.
Пероксиды щелочных металлов обычно представляют собой белые кристаллические вещества или порошки. Они обладают хорошей растворимостью в воде, образуя щелочные растворы. Пероксиды щелочных металлов обладают также хорошей растворимостью в спиртах и органических растворителях.
Одним из ключевых свойств пероксидов щелочных металлов является их окислительная активность. Благодаря наличию пероксидных групп, они способны передавать кислородные атомы другим веществам и протекать реакцию окисления. Пероксиды щелочных металлов часто применяются в качестве окислителей при проведении органических реакций.
Еще одним важным свойством пероксидов щелочных металлов является их способность разлагаться при нагревании или контакте с катализаторами. Это приводит к выделению кислорода и образованию гидроксидов металлов. Разложение пероксидов щелочных металлов может быть взрывоопасным, поэтому они могут использоваться в качестве источников кислорода или взрывчатых веществ.
Вывод: пероксиды щелочных металлов обладают характерными свойствами, такими как белый цвет, хорошая растворимость, окислительная активность и способность к разложению. Эти свойства определяют их широкое применение в различных химических процессах и реакциях.
Вопрос-ответ

Почему пероксиды щелочных металлов являются реактивными соединениями?
Пероксиды щелочных металлов являются реактивными соединениями из-за наличия двойной связи между атомами кислорода. Эта двойная связь делает пероксиды очень реакционноспособными, что может проявляться, например, в их способности окислять другие вещества или принимать участие в реакциях горения.
Для чего используются пероксиды щелочных металлов в промышленности?
Пероксиды щелочных металлов широко применяются в промышленности, так как они обладают множеством полезных свойств. Например, пероксид натрия находит применение в стекольной промышленности для удаления органических загрязнений с поверхности стекла. Также пероксиды щелочных металлов используются как отбеливающие и окислительные составляющие в различных химических процессах.
Можно ли использовать пероксиды щелочных металлов в бытовых условиях?
Пероксиды щелочных металлов имеют достаточно высокую активность и реактивность, поэтому обычно не рекомендуется использовать их в бытовых условиях. Их применение требует специальных мер предосторожности и соблюдения определенных правил безопасности. К тому же, пероксиды щелочных металлов могут быть токсичными и вызывать раздражение кожи и слизистых оболочек.
