Оксиды металлов - это химические соединения, состоящие из металлического элемента и кислорода. Они являются одним из наиболее распространенных классов соединений и имеют широкий спектр свойств и применений. Оксиды металлов могут быть кислыми, щелочными или нейтральными в зависимости от своей реакции с водой.
Основные оксиды металлов обладают щелочными свойствами и образуют гидроксиды при взаимодействии с водой. Эти соединения обычно имеют высокую точку плавления и агрегатное состояние в виде кристаллического вещества. Они часто используются в различных сферах, включая металлургию, катализ, электронику и другие области.
Примерами основных оксидов металлов являются оксид натрия (Na2O), оксид калия (K2O), оксид кальция (CaO), оксид магния (MgO) и др. Оксид натрия широко используется в производстве стекла и мыла, оксид калия - в производстве щелочей и удобрений, оксид кальция - в строительстве и производстве цемента, оксид магния - в производстве огнеупорных материалов и лекарственных препаратов.
Оксиды щелочных металлов

Щелочные металлы, такие как натрий, калий, литий, рубидий, цезий и франций, образуют оксиды, которые называются щелочными оксидами. Эти металлы находятся первыми в группе периодической системы и имеют свойство легко образовывать оксиды, проявляющие щелочные свойства при реакции с водой.
Оксид натрия (Na2O) является одним из наиболее известных оксидов щелочных металлов. Он представляет собой бесцветное кристаллическое вещество, которое легко растворяется в воде, образуя щелочной раствор. Он выступает как основание при взаимодействии с кислотами.
Оксид калия (K2O) также относится к щелочным оксидам. Он имеет сильные щелочные свойства и может вызывать ожоги при контакте с кожей и слизистыми оболочками. Он образует гидроксид калия (щелочную соль), когда взаимодействует с водой.
Оксид лития (Li2O) является еще одним примером щелочного оксида. Он имеет высокую температуру плавления и образует гидроксид лития (щелочную соль), когда взаимодействует с водой. Этот оксид используется в производстве стекла и керамики.
Оксиды щелочных металлов играют важную роль в различных отраслях промышленности и научных исследованиях. Они находят применение в производстве стекла, керамики, удобрений и щелочных батарей.
Оксиды щелочноземельных металлов
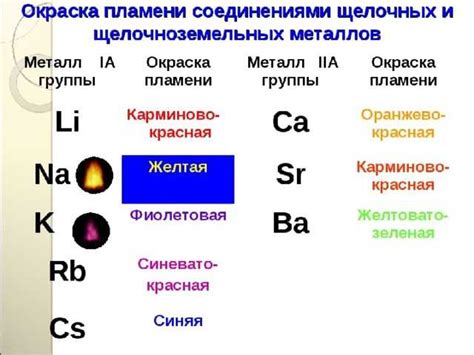
Щелочноземельные металлы - это химические элементы, которые принадлежат к группе 2 периодической таблицы. Такие металлы, как магний (Mg), кальций (Ca), стронций (Sr) и барий (Ba), образуют оксиды, которые известны как оксиды щелочноземельных металлов.
Оксиды щелочноземельных металлов обладают химической формулой MO, где M обозначает металл. Они характеризуются высокой кислотностью и щелочностью. Как правило, эти оксиды образуются в результате реакции щелочного металла с кислородом.
Примерами оксидов щелочноземельных металлов являются магнийоксид (MgO), кальцийоксид (CaO), стронцийоксид (SrO) и барийоксид (BaO). Они обладают высокой степенью термической стабильности и широко используются в различных отраслях промышленности.
Одним из основных применений оксидов щелочноземельных металлов является их использование в процессе производства стекла. Магнийоксид, кальцийоксид и стронцийоксид играют значительную роль в формировании свойств и характеристик стекла, таких как его прозрачность, термическая стабильность и механическая прочность.
Оксиды щелочноземельных металлов также используются в качестве катализаторов при различных химических реакциях. Они способны активировать определенные реакции благодаря своей высокой активности и поверхностной активности. Это делает их полезными компонентами в производстве пластмасс, водорода, синтетических материалов и других продуктов.
Оксиды переходных металлов
Оксиды переходных металлов представляют собой химические соединения, состоящие из кислорода и металлического элемента. Они обладают широким спектром свойств и применений, которые определяют их важность в различных отраслях промышленности и научной деятельности.
В состав оксидов переходных металлов входят такие элементы, как железо, цинк, медь, хром, никель и другие. Каждый из них обладает своими уникальными свойствами и ролю играет в разных процессах.
Оксиды переходных металлов могут быть как щелочными, так и амфотерными. Например, оксид железа FeO – щелочной оксид, он образуется при нагревании железа в присутствии кислорода. А оксид хрома Cr2O3 – амфотерный оксид, он реагирует и с кислотами, и с щелочами.
Оксиды переходных металлов находят применение в разных отраслях промышленности. Например, оксид железа Fe2O3 известен как окрашивающий пигмент и широко применяется в производстве красок и пигментов. Оксид никеля NiO используется в производстве катализаторов, а оксид хрома CrO3 – в химической промышленности при производстве красителей и пластиков.
Оксиды благородных металлов

Благородные металлы, такие как платина, золото и серебро, образуют основные оксиды, в которых металл находится в положительной ионной форме.
Например, платина образует два основных оксида, PtO и PtO2. PtO - это одноатомный основной оксид платины, который образуется при окислении платины при высоких температурах. Он имеет структуру ромбической кристаллической решетки и высокую температуру плавления.
Второй основной оксид платины, PtO2, представляет собой более стабильную форму оксида и образуется при контакте платины с кислородом воздуха при нормальных условиях. Он применяется в качестве катализатора в различных процессах, таких как производство водорода при электролизе воды.
Золото и серебро также образуют основные оксиды. Например, золото образует оксид Au2O3, который представляет собой черный порошок с низкой устойчивостью и используется в некоторых химических реакциях. Серебро образует оксид Ag2O, который является темно-коричневым соединением, активно взаимодействующим с различными соединениями.
Оксиды благородных металлов имеют различные свойства и применяются в различных областях, включая катализ, электронику и производство ювелирных изделий.
Оксиды легкоплавких металлов

Легкоплавкие металлы – это элементы, которые обладают низкой температурой плавления. Их оксиды также обладают этим свойством и могут запекаться при повышении температуры.
Примером оксида легкоплавкого металла является оксид натрия (Na2O), который является базовым оксидом. Он образуется в результате реакции натрия с кислородом. Оксид натрия широко используется в производстве стекла, мыла и щелочей.
Другим примером оксида легкоплавкого металла является оксид калия (K2O). Он также является базовым оксидом и используется в производстве щелочей, глазурей для керамики и оксидов других металлов.
Оксиды легкоплавких металлов характеризуются своими низкими температурами плавления, что делает их важными сырьем для различных производственных процессов. Они играют важную роль в промышленности и находят применение в различных отраслях, начиная от стекольной и керамической промышленности и заканчивая производством щелочных продуктов.
Оксиды тяжелых металлов
Оксиды тяжелых металлов – это соединения, которые образуются в результате реакции металла с кислородом. Такие оксиды обладают высокой плотностью, высокой температурой плавления и обычно имеют темный цвет.
Одним из примеров такого соединения является оксид свинца (PbO), который называется также основным оксидом свинца. Он представляет собой темно-коричневый порошок и обладает высокой плотностью.
Еще одним примером оксида тяжелого металла является оксид ртути (HgO), который также известен как основной оксид ртути. Этот оксид имеет красновато-желтый цвет и является твердым веществом.
Тяжелые металлы и их оксиды обладают рядом полезных свойств, которые нашли применение в различных областях. Например, оксид свинца используется в производстве стекла и красок, а оксид ртути применяется в производстве термометров и электродов.
В заключение, оксиды тяжелых металлов имеют разнообразные свойства и применения. Они являются важными соединениями в химической промышленности и находят широкое применение в различных отраслях науки и техники.
Оксиды металлоидов

Оксиды металлоидов - это соединения металлоидов с кислородом. Металлоиды - эти элементы переходны от металлов к неметаллам и обладают свойствами, характерными для обоих групп.
Основные оксиды металлоидов образуют сильные основания при растворении в воде. К ним относятся, например, оксиды азота, фосфора и серы. Ангидридами этих веществ являются, соответственно, диоксид азота, оксид фосфора и диоксид серы.
- Оксид азота (диоксид азота, NO2) - это газ с резким запахом, который образуется при сгорании азота в воздухе. Он является сильным окислителем и используется в качестве антибактериального, стерилизующего и консервирующего средства.
- Оксид фосфора (оксид пятиокиси фосфора, P2O5) - это белый кристаллический порошок, который реагирует с водой, образуя фосфорную кислоту. Он используется в химической промышленности для производства фосфатных удобрений и органических соединений.
- Оксид серы (диоксид серы, SO2) - это газ с характерным запахом, который образуется при сгорании серы. Он является одним из основных причин кислотного дождя и загрязнения воздуха. Однако оксид серы также используется в промышленности для производства других химических соединений, например, серной кислоты.
Оксиды металлоидов имеют различные применения в различных отраслях промышленности, медицине и науке. Они играют важную роль в создании новых материалов, лекарственных препаратов и катализаторов.
Оксиды лантаноидов и актиноидов

Лантаноиды и актиноиды – это ряд элементов в таблице химических элементов, которые находятся в блоках f-элементов периодической системы. Они включают 15 элементов лантаноидного ряда и 15 элементов актиноидного ряда.
Оксиды лантаноидов и актиноидов являются соединениями данных элементов с кислородом. Они имеют общую формулу Ln2O3, где Ln обозначает элемент лантаноидов или актиноидов. Каждый элемент этого ряда образует свое собственное оксидное соединение.
Оксиды лантаноидов и актиноидов обладают высокой степенью термической стабильности, что делает их хорошими материалами для использования в высокотемпературных приложениях.
Примеры оксидов лантаноидов включают оксид лантана (La2O3), оксид церия (CeO2) и оксид прасеодима (Pr6O11). Эти оксиды широко используются в производстве катализаторов, электродов, а также в процессах оксидации и воздействия на среду.
Примеры оксидов актиноидов включают оксид урана (UO2), оксид плутония (PuO2) и оксид америция (AmO2). Эти оксиды обладают высокой плотностью и используются в ядерной энергетике для производства топлива и радиоактивных материалов.
Вопрос-ответ

Какие металлы образуют основные оксиды?
Основные оксиды образуют металлы с положительными зарядами. Некоторые из них включают натрий, калий, кальций, магний, железо и алюминий.
Что такое основные оксиды?
Основные оксиды - это оксиды металлов, которые реагируют с водой, образуя основания или щелочи. Они характеризуются высоким содержанием металла и выраженной щелочной реакцией.
Какие примеры основных оксидов металлов можно привести?
Примеры основных оксидов металлов включают оксид натрия (Na2O), оксид кальция (CaO), оксид калия (K2O), оксид магния (MgO), оксид алюминия (Al2O3) и оксид железа (Fe2O3).
Для чего используются основные оксиды металлов?
Основные оксиды металлов используются в различных отраслях промышленности. Например, оксид кальция (известковая паста) используется в строительстве, а оксид натрия (щелочь) используется в производстве стекла и мыла. Оксиды металлов также используются в процессе производства керамики и красок.
