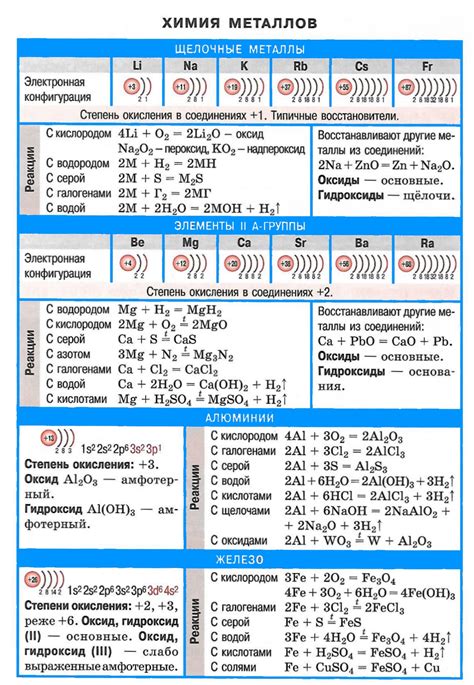
Щелочные металлы - это элементы периодической системы, отличающиеся высокой химической активностью и характерными особенностями своих свойств. Эти элементы включают литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Их названия получены из-за свойства их гидроксидов образовывать щелочные растворы при реакции с водой.
Помимо своей химической активности, щелочные металлы обладают рядом других особенностей. Они относятся к группе I периодической системы и характеризуются низкой плотностью, низкой температурой плавления и кипения, а также низкой твердостью. Более того, щелочные металлы обладают высокой электропроводностью, что делает их идеальными для применения в батареях и других электротехнических устройствах.
Химическая активность щелочных металлов проявляется в их способности образовывать ионы с положительным зарядом. При контакте с водой щелочные металлы реагируют с выделением водорода и образованием щелочных растворов. Они также обладают высокой реакционной способностью с кислородом, воздухом и другими веществами, что делает их мощными окислителями.
Особенности химической активности щелочных металлов объясняются их электронной структурой. Щелочные металлы имеют один электрон во внешней оболочке, что делает их склонными к потере этого электрона. В результате они образуют ионы с положительным зарядом, что дает им возможность эффективно реагировать с другими веществами.
Особенности химической активности щелочных металлов

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают высокой химической активностью. Их активность основана на структурных особенностях и электронных конфигурациях.
Первая особенность щелочных металлов заключается в том, что они имеют одну электрон на внешней оболочке, что делает их очень реакционноспособными. Это приводит к тому, что они легко потеряют этот электрон, чтобы образовать положительный ион.
Вторая особенность связана с их способностью реагировать с водой. Щелочные металлы, при контакте с водой, образуют щелочные растворы и выделяются водород. Реакция с водой особенно интенсивна у лития и натрия.
Третья особенность химической активности связана с их способностью образовывать соединения с кислородом. Щелочные металлы образуют оксиды, пероксиды и супероксиды. Например, пероксид натрия Na2O2 обладает окислительной активностью и используется в качестве источника кислорода в кислородных масках и баллонах.
Четвертая особенность связана с способностью щелочных металлов образовывать растворимые гидроксиды. Гидроксиды щелочных металлов имеют высокую щелочность и широко используются в промышленности и быту.
В целом, особенности химической активности щелочных металлов связаны с их способностью образовывать ионы с положительным зарядом, реагировать с водой и кислородом, а также образовывать растворимые гидроксиды.
Физические свойства щелочных металлов

1. Электропроводность. Щелочные металлы, такие как литий, натрий, калий и другие, обладают высокой электропроводностью. Они являются отличными проводниками электрического тока и могут использоваться в производстве батарей, электродов и других устройств, где требуется хорошая электрическая проводимость.
2. Мягкость и пластичность. Щелочные металлы обладают мягкой и пластичной структурой, что позволяет их легко обрабатывать и формировать в различные изделия. Благодаря этим свойствам они находят применение в различных областях промышленности, включая производство сплавов, стекла и керамики.
3. Низкая плотность. Щелочные металлы имеют низкую плотность, что означает, что они очень легкие. Например, литий – самый легкий металл. Это свойство делает их привлекательными для использования в легких конструкциях, таких как авиационная и космическая промышленность, где вес является важным фактором.
4. Высокая температура плавления. Щелочные металлы обладают высокой температурой плавления, что означает, что они могут пребывать в жидком состоянии даже при высоких температурах. Например, точка плавления калия составляет около 63°C. Это свойство делает их полезными в производстве различных сплавов и стеклов, а также в высокотемпературных процессах, таких как плавление металлов и горение.
5. Инертность в воздухе. Щелочные металлы, как правило, обладают инертностью в воздухе, что значит, что они не реагируют с кислородом и не окисляются. Однако, некоторые щелочные металлы, такие как литий и натрий, могут реагировать с влажным воздухом и образовывать оксиды и гидроксиды. Это свойство делает их чувствительными к воздействию окружающей среды и требует специальных условий хранения и использования.
6. Низкая твердость. Щелочные металлы обычно имеют низкую твердость, что означает, что их легко режут, царапают и деформируют. Однако, есть исключение – литий, который является самым твердым из щелочных металлов и используется в производстве литиевых батарей и других электронных устройств.
Химические свойства щелочных металлов

Щелочные металлы - это элементы первой группы Периодической системы, которые характеризуются высокой химической активностью и легкостью образования ионов с положительным зарядом. Основными представителями щелочных металлов являются литий (Li), натрий (Na), калий (K), рубидий (Rb) и цезий (Cs).
Одной из основных химических свойств щелочных металлов является их способность реагировать с водой с образованием щелочей. Такое взаимодействие приводит к образованию гидроксидов соответствующих металлов и выделению водорода. Например, литий реагирует с водой по следующей реакции: 2Li + 2H2O -> 2LiOH + H2.
Щелочные металлы также легко взаимодействуют с кислородом воздуха и образуют оксиды. Реакция между натрием и кислородом приводит к образованию оксида натрия: 4Na + O2 -> 2Na2O. Данные оксиды обладают щелочными свойствами и могут реагировать с водой, образуя гидроксиды.
Щелочные металлы также способны образовывать соли, реагируя с кислотами. В результате таких реакций образуются соответствующие щелочные металлы с положительным зарядом и отрицательно заряженные ионы кислот или ангидридов. Для примера, натрий реагирует с соляной кислотой, образуя хлорид натрия и выделяясь молекулы воды: 2Na + 2HCl -> 2NaCl + H2.
Алкалиметрические методы определения щелочных металлов
Щелочные металлы, такие как литий, натрий, калий и др., в основном характеризуются химической активностью и свойствами щелочных растворов. Из-за своей высокой реакционной способности они широко используются в аналитической химии для определения различных веществ.
Одним из наиболее распространенных методов определения щелочных металлов является алкалиметрия. В основе этого метода лежит использование реакций между щелочными металлами и кислотами, при которых происходит образование солей. Алкалиметрия позволяет точно определить содержание щелочных металлов в различных образцах.
Для проведения алкалиметрического определения используются различные индикаторы, которые меняют цвет в зависимости от pH раствора. Также нередко применяется градуировка, при которой измеряется объем кислоты или щелочи, необходимый для полного нейтрализации.
Одним из примеров алкалиметрического метода определения щелочных металлов является титрование раствора щелочи с помощью стандартного раствора кислоты. При этом сначала определяют концентрацию стандартного раствора кислоты путем градуировки, а затем титруют раствор щелочи до нейтрализации и определяют его концентрацию.
Таким образом, алкалиметрические методы определения щелочных металлов являются важным инструментом в аналитической химии. Они позволяют точно определить содержание и концентрацию щелочных металлов в различных образцах и используются во многих отраслях науки и промышленности.
Применение щелочных металлов

Щелочные металлы - это группа элементов, которые имеют широкое применение в различных отраслях нашей жизни. Они обладают рядом уникальных свойств, которые делают их полезными в различных сферах:
- В лаборатории: Щелочные металлы, такие как литий, натрий и калий, используются в химических лабораториях для проведения различных экспериментов и синтеза органических соединений. Они могут использоваться в качестве реагентов, а также в процессе выделения и анализа различных веществ.
- В электротехнике: Литий и натрий применяются в производстве аккумуляторов. Щелочные металлы обладают высокой электроотрицательностью, что делает их идеальными для использования в электронных устройствах и мобильных телефонах. Кроме того, калий используется в качестве электролита в некоторых типах батарей, благодаря своей способности проводить электрический заряд.
- В металлургии: Калий и натрий применяются в процессе производства алюминия. Они используются в качестве флюсов, улучшающих процесс таяния и отделения алюминия от его оксидов. Благодаря добавлению щелочных металлов, процесс обработки алюминия становится более эффективным и экономичным.
В сельском хозяйстве: Калийное удобрение, известное как калиевые соли, является одним из основных компонентов приготовления удобрений для повышения урожайности почвы. Щелочные металлы, особенно калий, играют важную роль в сельском хозяйстве, улучшая питательные свойства почвы и способствуя росту растений.
В производстве стекла: Натрий широко используется в производстве стекла. Он позволяет снизить температуру плавления сырья, улучшает его текучесть и делает стекло прозрачным. Литий также может быть добавлен в стеклянные компоненты для улучшения его механических свойств.
В заключение, щелочные металлы имеют множество применений, и их уникальные свойства делают их важными компонентами в различных отраслях научных и промышленных сфер.
Стойкость щелочных металлов в окружающей среде
Щелочные металлы - это группа элементов, включающих в себя литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они отличаются высокой реакционной способностью и химической активностью. В то же время, они нестабильны в окружающей среде и подвержены различным видам реакций с веществами, которые встречаются в природе.
Взаимодействие щелочных металлов с кислородом является одной из основных причин их нестабильности. Однако, стойкость щелочных металлов в окружающей среде может быть улучшена путем создания защитных покрытий, например, оксидных или нитридных пленок.
При контакте с водой, щелочные металлы реагируют с образованием щелочных гидроксидов и выделением водорода. Также, они способны реагировать с влажным воздухом, диоксидом углерода и другими химическими соединениями, что приводит к образованию оксидов, нитридов или пероксидов.
Для повышения стойкости щелочных металлов в окружающей среде могут быть использованы специальные методы, такие как модификация поверхности или покрытие защитными материалами. Например, имплантация ионов других элементов или нанесение слоя пластика или полимеров могут значительно увеличить стойкость и долговечность щелочных металлов.
Однако, несмотря на все усилия, щелочные металлы все еще являются относительно нестабильными элементами, и их использование в различных областях ограничено. Более того, их большая реакционная способность и химическая активность могут представлять опасность при неправильном обращении или хранении.
Вопрос-ответ

Какие свойства характерны для щелочных металлов?
Щелочные металлы обладают рядом характерных свойств. Они являются металлами серебристого цвета, мягкими и хорошо проводят тепло и электричество. Кроме того, они реагируют с водой, образуя щелочные растворы, и обладают высокой химической активностью.
Как проявляется химическая активность щелочных металлов?
Щелочные металлы проявляют высокую химическую активность из-за наличия одной валентной электронной оболочки. Они легко вступают в реакцию с кислородом, образуя оксиды, и с водой, образуя гидроксиды. Они также реагируют с неметаллами, образуя соли, и с кислотами, образуя соответствующие соли и выделяя водород.
Какие особенности свойств щелочных металлов можно выделить?
Среди особенностей свойств щелочных металлов можно выделить их низкую плотность, низкую температуру плавления и кипения, а также низкую твердость. Они также имеют низкую энергию ионизации, что делает их легко ионизируемыми. Кроме того, они образуют ионы с одной положительной зарядом и имеют большую электропроводность.
