Химическая связь, или схема образования связи, является основным понятием в химии и играет важную роль в изучении различных веществ и их реакций. Одним из наиболее интересных и сложных для понимания типов связей является металлическая связь. Она характеризуется особыми свойствами, которые отличают ее от других типов химической связи, таких как ионная и ковалентная связи.
Металлическая связь объясняет характерные свойства металлов, такие как теплопроводность, электропроводность и пластичность. Она основана на сильном притяжении между атомами металла и их способности обмениваться свободными электронами. Такая общая "пул" электронов, называемая "электронным облаком", создает прочную связь между атомами металла, что позволяет им быть довольно мягкими и податливыми.
Металлическая связь можно представить схематический следующим образом:
Каждый атом металла отдает один или несколько своих электронов, образуя позитивно заряженный ион. Эти электроны образуют электронное облако, окутывающее положительные ионы. В результате этой связи электронное облако становится общией для всех атомов металла, что в свою очередь создает сильное и эластичное электростатическое притяжение между атомами металла.
Такая схема образования химической связи в металлах объясняет их способность проводить ток, так как свободные электроны могут двигаться внутри металла и переносить электрический заряд. Кроме того, металлы обладают высокими температурами плавления и кипения, так как эта сильная металлическая связь требует большой энергии для ее слома. В результате, металлическая связь является одной из самых прочных и устойчивых химических связей в природе.
Связь между атомами металла
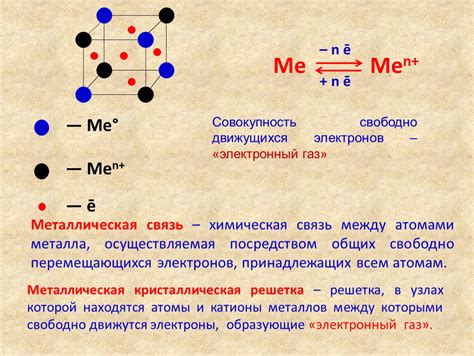
Химическая связь в металлах отличается от связи в молекулярных соединениях. В металлах атомы связаны между собой через общие электроны и образуют кристаллическую решетку. Такая связь называется металлической связью.
Металлическая связь обладает рядом особенностей. Во-первых, атомы металла образуют положительные ионы, отдавая свои валентные электроны, которые образуют электронное море вокруг положительных ионов. Такая модель называется моделью "электронного моря".
Во-вторых, металлическая связь характеризуется высокой электропроводностью и теплопроводностью, так как электроны свободно передвигаются по металлической решетке.
Также металлическая связь обеспечивает металлам их основные физические и химические свойства, такие как пластичность, деформируемость, низкая температура плавления, гладкость поверхности и другие.
Одной из особенностей металлической связи является ее неоднородность в металлах с разными кристаллическими структурами. Например, у каждого металла может быть своя конкретная форма кристаллической решетки, что влияет на его свойства и характеристики.
Определение и значимость химической связи в металлах

Химическая связь в металлах является основной составляющей их структуры и определяет большинство их физических и химических свойств. Она образуется между атомами металла и характеризуется способностью электронов свободно двигаться в кристаллической решетке металла.
Металлы обладают высокой электропроводностью и теплопроводностью благодаря наличию свободных электронов, которые могут свободно передвигаться по металлической решетке и переносить электрический и тепловой заряды. Более того, свободные электроны являются основной причиной блеска металлов.
Химическая связь в металлах также отвечает за их пластичность и тугоплавкость. В металлах атомы находятся в кристаллической решетке, образующей сеть упорядоченных атомных позиций. Атомы в этой сети могут легко перемещаться без разрушения связи, поэтому металлы обладают высокой пластичностью и легко поддаются формованию. Также, благодаря свободным электронам, металлы имеют низкую температуру плавления.
Итак, химическая связь играет ключевую роль в структуре металлов и определяет их основные физические и химические свойства. Свободные электроны в металлах обуславливают их высокую электропроводность и теплопроводность, а также пластичность и низкую тугоплавкость. Понимание и изучение химической связи в металлах важно для разработки новых материалов с желаемыми свойствами.
Ковалентная связь в металлах

Ковалентная связь является одним из типов химической связи, которая возникает между атомами в молекулах или кристаллах. Однако, в отличие от молекулярных веществ, металлы образуют специфическую схему образования химической связи, называемую ковалентной связью в металлах.
Основным звеном в ковалентной связи металлов являются электроны внутренней оболочки. Они образуют так называемую "область заблокированности", где электроны не имеют возможности свободно двигаться. Эти электроны создают эффект притяжения и удерживают атомы металла в компактном кристаллическом решетке.
В металлах химическая связь не локализуется между отдельными атомами, а простирается на всю структуру кристаллической решетки. Это обеспечивает высокую прочность и твердость металлов, а также их способность проводить тепло и электричество.
Ковалентная связь в металлах также характеризуется наличием свободных электронов, которые могут передвигаться внутри кристаллической решетки. Это явление называется электронной оболочкой металла. Свободные электроны обладают высокой подвижностью и отвечают за основные свойства металлов, включая их хорошую проводимость электричества и тепла.
Металлическая связь

Металлическая связь является одной из основных форм химической связи между атомами металлов. Эта связь характеризуется тем, что электроны внешней оболочки атомов металла образуют общую "электронную облако", которое окружает положительные ядра атомов.
Металлическая связь обладает такими характеристиками, как высокая электропроводность, облегченная деформация и высокая теплоотдача. Это объясняется тем, что свободные электроны в металлической связи могут свободно двигаться в "электронном облаке" и передавать энергию источникам или другим атомам.
Процесс образования металлической связи происходит в металлических кристаллах, где атомы металла упорядочены в решетку. При этом каждый атом металла отдает некоторое количество своих электронов на общую связь с другими атомами. Таким образом, в металлической связи присутствуют свободные электроны, которые делают металлы электропроводными и обладающими специфическими свойствами.
Ионная связь в металлах

Ионная связь в металлах представляет собой вид химической связи, при которой металл, как катион, образует положительно заряженное ядро, окружающее облако электронов. Она характеризуется переносом электрона от атома металла на атом, образующий отрицательно заряженный ион. Такие связи образуются между металлами и неметаллами, при этом металл передает электрон неметаллу, что в результате образует ионы с противоположными зарядами.
В ионной связи силы притяжения электрических зарядов играют основную роль. Поэтому ионная связь прочна, но в то же время хрупкая. Вещества с ионной связью обычно обладают высокой температурой плавления и кипения, а также электропроводностью в расплавленном состоянии или в растворе.
В ионной связи катионы и анионы, образующиеся в результате переноса электрона, образуют кристаллическую решетку. Электроны, находящиеся на внешней энергетической оболочке, могут свободно перемещаться между атомами металла, что обуславливает их высокую электропроводность.
Примером металла с ионной связью является натрий. При переходе вещества в жидкое или газообразное состояние силы притяжения между ионами ослабевают, что приводит к возможности перемещения свободных электронов. Благодаря этому натрий обладает высокой электропроводностью и может использоваться в качестве проводника электрического тока.
Смешанная химическая связь в металлах

Смешанная химическая связь в металлах является основной формой связи между атомами металла. Она объединяет свойства и характеристики обычной ковалентной связи со свойствами металлического связующего вещества.
Смешанная химическая связь в металлах основана на свойствах электронной структуры металлических атомов. Металлические атомы имеют особенность в том, что они обладают свободными электронами в своей внешней оболочке. Эти свободные электроны, называемые электронами проводимости, способны свободно перемещаться по кристаллической решетке металла.
Смешанная связь в металлах характеризуется тем, что металлические атомы образуют ковалентные связи с несколькими соседними атомами, образуя так называемый "металлический связующий валентный кластер". Этот кластер состоит из металлических атомов и связанных между собой электронов проводимости. Такая структура металлической связи придает металлам их характерные свойства, такие как высокая теплопроводность и электропроводность.
Смешанная химическая связь в металлах также обуславливает их способность образовывать сплавы. В сплавах разные металлы могут образовывать смешанные кристаллические решетки, в которых электроны проводимости свободно перемещаются между различными типами атомов. Это позволяет сплавам обладать уникальными физическими и химическими свойствами, которые по-отдельности металлы не могут достичь.
Особенности схемы образования химической связи в металлах

Химическая связь в металлах представляет собой особую форму взаимодействия атомов, обусловленную специфическим строением кристаллической решетки.
Основными особенностями образования химической связи в металлах являются:
- Электронное облако. Металлическая связь основывается на свободном движении электронов в атомах металла, образуя электронное облако, которое является общим для всех атомов вещества.
- Электронный газ. Благодаря свободному движению электронов, в металлах образуется так называемый электронный газ, способный обеспечивать проводимость и другие специфические свойства металлов.
- Металлическая решетка. Атомы металлов в кристаллической решетке обладают ордером, тесно упакованы и создают трехмерную структуру, что обуславливает механическую прочность металлов.
Металлическая связь обладает такими особенностями, как высокая теплопроводность и электропроводность, обусловленные свободным движением электронов. Кроме того, металлы обладают высокой пластичностью и способностью образовывать различные кристаллические структуры.
Важно отметить, что химическая связь в металлах имеет сильный направленный характер, что объясняется наличием определенного порядка в кристаллической решетке. Это позволяет металлам образовывать специфические связи с другими веществами, такими как ионы или молекулы.
Вопрос-ответ

Каким образом образуется химическая связь для металла?
Химическая связь для металла образуется путем обмена электронами между атомами металла и атомами других элементов.
Какие есть виды химической связи для металла?
Существует несколько видов химической связи для металла, таких как металлическая связь, ионная связь и ковалентная связь.
Что определяет силу химической связи для металла?
Сила химической связи для металла определяется энергией обмена электронами между атомами металла и атомами других элементов.
Какие факторы влияют на формирование химической связи для металла?
На формирование химической связи для металла могут влиять такие факторы, как энергия атомов, их электроотрицательность и структура металлической решетки.
