Оксиды щелочных металлов – это химические соединения, состоящие из щелочных металлов (натрия, калия, рубидия, цезия) и кислорода. Щелочные металлы находятся в первой группе периодической системы, а оксиды являются результатом их реакции с кислородом.
Состав оксидов щелочных металлов зависит от типа металла и условий реакции. Обычно они представляют собой ионные соединения, в которых щелочные металлы находятся в состоянии окисления +1, а кислород – в состоянии окисления -2. Формула оксидов щелочных металлов имеет вид M2O, где M обозначает металл.
Оксиды щелочных металлов обладают рядом важных свойств, которые определяют их применение в различных областях науки и техники. Во-первых, они являются диэлектриками и хорошими теплоизоляторами. Благодаря этим свойствам, оксиды щелочных металлов активно используются в производстве электронных компонентов, изоляторов с высокой температурой плавления и других материалов, применяемых в высоких температурах.
Кроме того, оксиды щелочных металлов обладают щелочными свойствами, то есть они растворяются в воде и образуют гидроксиды. Например, оксид натрия (Na2O) взаимодействует с водой и образует гидроксид натрия (NaOH), который широко используется в промышленности и быту, в том числе в процессе производства стекла, мыла и моющих средств.
Щелочные металлы: что это такое?
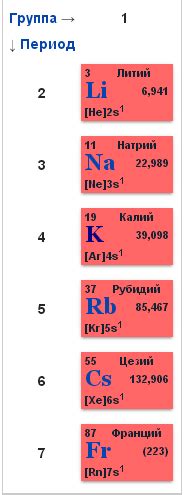
Щелочные металлы - это группа химических элементов, которая включает литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они относятся к первой группе периодической системы элементов и характеризуются высокой активностью и химической реактивностью.
Названия щелочных металлов происходят от их способности образовывать гидроксиды, которые имеют щелочную реакцию. Щелочные металлы имеют низкую плотность, низкую температуру плавления и кипения, а также мягкую консистенцию. Они являются отличными проводниками электричества и тепла, что делает их незаменимыми материалами в различных областях науки и техники.
Щелочные металлы обладают сходными химическими свойствами. Они легко реагируют с водой, образуя гидроксиды и высвобождая водород. Щелочные металлы также способны образовывать соли с различными кислотами. Кроме того, их соединения широко применяются в синтезе органических и неорганических соединений, производстве стекла, керамики, щелочных батарей и др.
Оксиды: основные свойства и структура
Оксиды - это химические соединения, состоящие из одного атома кислорода и другого химического элемента. Важным классом оксидов являются оксиды щелочных металлов, таких как натрий (Na2O), калий (K2O) и литий (Li2O).
Одно из основных свойств оксидов щелочных металлов - это их способность образовывать щелочные растворы при взаимодействии с водой. Это свойство обусловлено наличием ионов гидроксида (OH-) в растворе, образующихся в процессе гидролиза оксида.
Оксиды щелочных металлов также обладают высокой реактивностью и способностью окислять другие вещества. Это свойство обусловлено наличием одновалентных катионов щелочных металлов (Na+, K+, Li+), которые могут передавать электроны и участвовать в реакциях окисления-восстановления.
Структура оксидов щелочных металлов обычно представляет собой кристаллическую решетку, в которой атомы кислорода и катионы щелочных металлов занимают определенные позиции. Прочность структуры оксидов обусловлена электростатическими силами притяжения между заряженными частицами.
Оксиды щелочных металлов: основные представители

Оксиды щелочных металлов представляют собой соединения, состоящие из щелочного металла и кислорода. Семь щелочных металлов – литий, натрий, калий, рубидий, цезий, франций и оксиды, которые они образуют, обладают рядом сходных свойств и характеристик.
Одним из наиболее известных представителей оксидов щелочных металлов является оксид натрия, также известный как кальцинированная сода или пищевая сода. Он широко используется в различных областях, в том числе в пищевой промышленности, медицине и производстве стекла. Оксид натрия обладает щелочными свойствами и может реагировать с кислотами, образуя соли и воду.
Оксид калия, или калийная щелочь, также является значительным представителем оксидов щелочных металлов. Он обладает повышенной щелочностью и используется в производстве щелочных растворов, удобрений, стекла и мыла. Калийная щелочь также может использоваться в лабораторных условиях для регулирования pH.
Кроме оксида натрия и оксида калия, также существуют оксиды других щелочных металлов, такие как оксид лития, оксид рубидия и оксид цезия. Они имеют схожие свойства с основными представителями, и их применение в различных областях тоже широко распространено.
Физические свойства оксидов щелочных металлов
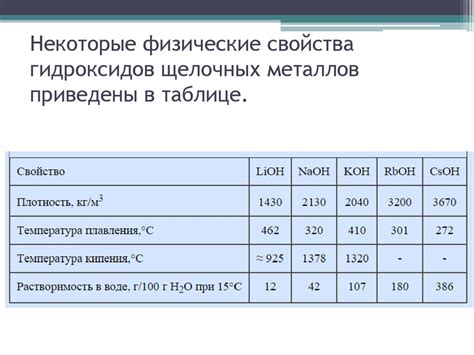
Оксиды щелочных металлов - это химические соединения, в которых кислород соединяется с щелочными металлами. Они имеют сильнокристаллическую структуру и обычно формируют кубическую решетку. Оксиды щелочных металлов обладают высокой теплопроводностью и электропроводностью.
Одной из важных физических характеристик оксидов щелочных металлов является их плотность. Плотность оксидов щелочных металлов обычно высокая и составляет около 2 г/см³. Это связано с их кристаллической структурой и наличием большого количества атомов металла и кислорода в единице объема.
Цвет оксидов щелочных металлов зависит от состояния оксидной группы в соединении. Например, оксид натрия (Na2O) имеет белый цвет, а оксид калия (K2O) - желтый. Оксиды щелочных металлов также обладают высоким показателем показателя преломления, что может влиять на их оптические свойства и использование в оптических устройствах.
Оксиды щелочных металлов обычно не летучие и имеют высокую температуру плавления и кипения. Например, оксид натрия имеет температуру плавления 1130 °C, а оксид калия - 3010 °C. Это обусловлено сильными химическими связями между атомами металлов и кислорода.
Оксиды щелочных металлов обычно растворимы в воде и образуют гидроксиды соответствующих металлов. Растворимость оксидов щелочных металлов может зависеть от их концентрации и температуры. Растворение оксида натрия в воде сопровождается выделением большого количества тепла и образованием щелочного раствора.
Химические свойства оксидов щелочных металлов

Оксиды щелочных металлов – это химические соединения, образующиеся при реакции щелочного металла с кислородом. Химические свойства этих соединений характеризуются их реакционной способностью и способностью образовывать растворы.
Оксиды щелочных металлов обладают щелочными свойствами, что проявляется в способности образовывать щелочные растворы при взаимодействии с водой. Данная реакция сопровождается выделением тепла и образованием гидроксида щелочного металла. Сильные оксиды таких металлов, как натрий и калий, реагируют с водой даже без нагревания и вызывают сильное щелочное действие.
Оксиды щелочных металлов также обладают кислородными свойствами. Они могут взаимодействовать с кислотами, при этом образуется соль и вода. Это реакция окисления, в результате которой происходит передача электронов между реагирующими веществами. Образование солей и воды является результатом нейтрализации щелочного оксида и кислоты. Такие реакции играют важную роль во многих химических процессах, включая производство минеральных удобрений и фармацевтических препаратов.
Химические свойства оксидов щелочных металлов также зависят от их реакционной способности с другими химическими веществами. Например, оксиды лития, натрия и калия реагируют с диоксидом углерода, образуя карбонаты щелочных металлов и освобождая кислород. Этот процесс имеет важное применение в промышленности при проведении огнетушения и в других технологических процессах.
Вопрос-ответ

Какие элементы относятся к щелочным металлам?
К щелочным металлам относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Каковы основные свойства оксидов щелочных металлов?
Оксиды щелочных металлов химически активны, обладают щелочными свойствами и растворяются в воде, образуя щелочные растворы. Они образуются в результате реакции металла с кислородом и могут быть представлены формулой MO, где M - щелочный металл.
