Кислоты щелочных металлов - это класс химических соединений, которые образуются при реакции щелочных металлов с кислотными соединениями. Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, имеют низкую электроотрицательность и легко образуют ионы с положительным зарядом. Когда они реагируют с кислотами, происходит образование соединений, которые имеют в своей структуре ионные связи.
Кислоты щелочных металлов обладают рядом особых свойств. Во-первых, они обычно имеют высокую степень растворимости в воде. Это связано с тем, что ионные связи внутри соединений щелочных металлов и кислоты легко разрушаются в присутствии воды, образуя ионы. Эти ионы растворяются в воде и создают щелочную среду.
Кроме того, кислоты щелочных металлов обладают выраженной активностью в реакциях. Они легко взаимодействуют с другими химическими веществами, образуя новые соединения и претерпевая различные химические переходы. Помимо реакции с водой, кислоты щелочных металлов могут реагировать с кислотами, окислителями, основаниями и многими другими веществами.
Часто кислоты щелочных металлов используются в различных областях, включая химическую промышленность, лабораторную практику и медицину. Они нашли применение в производстве различных веществ, таких как удобрения, мыла и стекло. Кроме того, кислоты щелочных металлов играют важную роль в биологических процессах и могут быть использованы в качестве лекарственных препаратов.
Состав и происхождение кислоты щелочных металлов
Кислота щелочных металлов представляет собой соединение, образующееся при реакции щелочного металла с водой. Она обладает кислотными свойствами, так как в ее состав входит один или несколько атомов водорода, способных отдавать протоны.
Щелочные металлы, такие как литий (Li), натрий (Na), калий (K) и другие, обладают активной металлической природой и легко реагируют с водой. При этом происходит ионизация металла и образование гидроксид-иона (OH-) и иона металла (M+).
В результате реакции щелочного металла с водой образуется гидроксид металла, который в свою очередь может диссоциировать, освобождая ион гидроксида (OH-) и металлический катион (M+). Ион гидроксида обуславливает кислотные свойства щелочной металлической кислоты.
Состав кислоты щелочных металлов включает в себя гидроксид металла и ион гидроксида. Например, кислота лития (LiOH) состоит из одного атома лития, одной молекулы воды и одного иона гидроксида. Аналогично, кислота натрия (NaOH) состоит из натрия, воды и иона гидроксида.
Кислоты щелочных металлов обладают щелочными свойствами и широко используются в различных областях, таких как химическая промышленность, медицина, наука и технологии.
Основные характеристики щелочных металлов

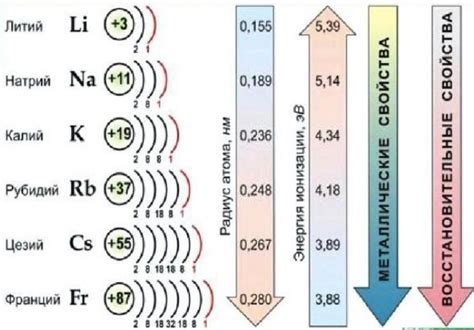
Щелочные металлы представляют собой группу элементов I группы периодической системы, включающую литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Эти элементы характеризуются рядом основных характеристик, которые определяют их поведение и применение в различных областях науки и промышленности.
Первой характеристикой щелочных металлов является их низкая плотность. Все щелочные металлы, за исключением лития, имеют плотность меньше, чем у воды. Натрий и калий, например, обладают плотностью около 0,97 г/см³, что делает их легкими и удобными в использовании в различных приложениях.
Щелочные металлы являются отличными проводниками электричества и тепла. Они обладают высокой электрической и теплопроводностью, что делает их полезными в производстве электрических проводников и теплоотводящих материалов. Кроме того, щелочные металлы легко ионизируются, что позволяет им образовывать ионы с положительным зарядом и взаимодействовать с другими веществами.
Одним из наиболее важных свойств щелочных металлов является их химическая активность. Они очень реактивны и легко вступают в химические реакции с другими элементами. Взаимодействие щелочных металлов с кислотами приводит к образованию солей, что делает их ценными компонентами в производстве различных химических соединений.
Стоит отметить, что щелочные металлы являются крайне воспламенительными. Они реагируют с водой, кислородом и другими веществами, выделяя большое количество тепла и иногда вызывая возгорание. Поэтому при работе с щелочными металлами необходимо соблюдать особые меры предосторожности.
Sum, Up, есть и другие характеристики щелочных металлов, такие как низкая температура плавления и кипения, способность образовывать сплавы и многое другое. Эти свойства делают щелочные металлы важными компонентами в различных областях, включая энергетику, металлургию, фармацевтику и электронику.
Образование и свойства кислоты щелочных металлов
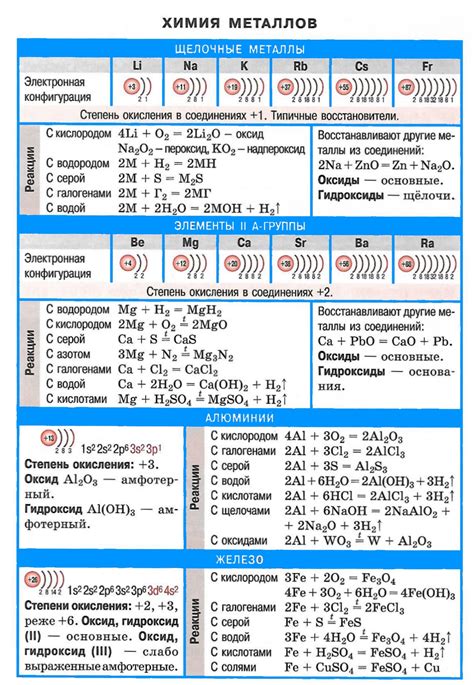
Кислота щелочных металлов образуется в результате реакции щелочного металла с водой или кислым оксидом или гидрооксидом этого металла. Кислотная реакция щелочных металлов приводит к образованию ионов металла и гидроксидных ионов. Например, реакция натрия с водой дает растворимую кислоту с ионами натрия и гидроксидной группой.
Свойства кислоты щелочных металлов включают ее высокую степень растворимости в воде и щелочную природу. Кислотность кислоты щелочных металлов обуславливается присутствием гидроксидной группы, которая может высвободить ион H+ в водном растворе. Щелочные металлы, будучи сильными основаниями, образуют кислоты, которые могут реагировать со стеклом, металлами и органическими веществами.
Одно из свойств кислоты щелочных металлов - они являются электролитами, то есть растворяются в воде, образуя ионы. Это обусловлено способностью гидроксидной группы щелочного металла протекать диссоциативную реакцию, при которой образуются положительные ионы металла и отрицательные ионы гидроксида. Эти ионы обладают свойствами основания и при взаимодействии с водой приводят к образованию растворимой кислоты.
Таким образом, кислота щелочных металлов образуется в результате реакции металла с водой или кислыми оксидами или гидрооксидами металла. Кислота щелочных металлов обладает свойствами основания и характеризуется высокой степенью растворимости в воде. Это делает ее важным соединением в различных областях науки и промышленности.
Свойства и применение кислоты щелочных металлов

Кислоты щелочных металлов обладают рядом уникальных свойств, которые определяют их применение в различных отраслях промышленности и научных исследованиях.
Одним из основных свойств кислот щелочных металлов является их высокая щелочность. Они способны растворять в себе различные вещества, такие как металлы, оксиды и гидроксиды. Благодаря этому свойству, кислоты щелочных металлов широко применяются в процессе очистки различных поверхностей, в том числе в металлообработке, химической промышленности и производстве бытовых товаров.
Еще одним важным свойством кислот щелочных металлов является их реакция с кислородом. Кислоты щелочных металлов способны быстро окисляться и реагировать с кислородом воздуха. Это свойство позволяет использовать кислоты щелочных металлов в процессе обработки пищевых продуктов для улучшения их сохранности и предотвращения окисления. Кроме того, кислоты щелочных металлов широко применяются в электрохимии и в процессе создания различных химических соединений.
Кислоты щелочных металлов также обладают высокой прочностью и стойкостью к воздействию различных условий окружающей среды. Это позволяет использовать их в процессе производства различных материалов, таких как стекло, керамика и полимеры. Кроме того, кислоты щелочных металлов нашли применение в процессе производства удобрений, где используются в качестве источника макроэлементов, необходимых для роста растений.
В итоге, кислоты щелочных металлов обладают широким спектром свойств и применений. Они находят применение в различных отраслях промышленности, научных исследованиях и производстве бытовых товаров. Благодаря своим уникальным химическим свойствам, кислоты щелочных металлов остаются неотъемлемой частью современного мира.
Реакция с водой: образование щелочей

Щелочные металлы, такие как натрий, калий и литий, обладают способностью вступать в реакцию с водой, формируя щелочные соединения и высвобождая водород. Эта реакция является одной из основных характеристик щелочных металлов.
Когда щелочный металл взаимодействует с водой, происходит следующая реакция: металл образует гидроксид и освобождает водород. Например, натрий реагирует с водой, образуя гидроксид натрия и выделяя водородный газ:
2Na + 2H2O → 2NaOH + H2
Образовавшийся в результате реакции гидроксид натрия является щелочью, которая обладает рядом химических и физических свойств. Щелочь обладает щелочным вкусом, является растворимой в воде и обладает щелочными свойствами, такими как нейтрализация кислот и образование соляных соединений.
Реакция щелочных металлов с водой является важным физико-химическим процессом и широко используется в различных областях, таких как производство щелочей, химический анализ и энергетика. Кроме того, щелочные металлы находят применение в различных промышленных производствах и бытовых нуждах.
Значение кислот щелочных металлов в промышленности

Кислоты щелочных металлов, такие как гидроксид натрия (NaOH) или гидроксид калия (KOH), широко используются в промышленности благодаря своим уникальным свойствам и реактивности.
Одним из главных применений кислот щелочных металлов является производство мыла. Гидроксид натрия или калия используются в процессе щелочного превращения жиров и масел в мыло. Этот процесс, известный как сапонификация, осуществляется путем реакции жиров с горячим раствором гидроксида натрия или калия.
Кислоты щелочных металлов также широко применяются в промышленности для регулирования pH значения растворов. Из-за своей щелочной природы, они обладают сильными свойствами нейтрализации и могут использоваться для изменения кислотно-щелочного баланса в различных процессах производства.
Кроме того, кислоты щелочных металлов используются в качестве электролитов в батареях. Гидроксид натрия и калия широко применяются в различных типах батарей, включая щелочные батареи и никель-металлгидридные батареи. Эти кислоты обеспечивают необходимую проводимость и электролитическую реакцию внутри батареи, позволяя ей работать эффективно.
Таким образом, кислоты щелочных металлов играют важную роль в промышленных процессах, обеспечивая эффективные реакции, регулирование pH и поддержку работы батарей. Их уникальные свойства и широкий спектр применений делают их неотъемлемыми компонентами во многих отраслях промышленности.
Вопрос-ответ

Какие основные свойства и факты о составе кислоты щелочных металлов?
Состав кислоты щелочных металлов включает в себя один атом щелочного металла и одну или несколько кислородных групп. Кислоты щелочных металлов обычно обладают щелочными свойствами, то есть имеют способность реагировать с кислотами и образовывать соли. Они также могут быть использованы в различных промышленных процессах и в химическом синтезе.
Какой состав имеет кислота калия?
Кислота калия (KOH) состоит из одного атома калия, одного атома кислорода и одного атома водорода. Эта кислота встречается в природе в виде минерала калиевого щелочного гидроксида, также известного как пижмонит. Кислота калия обладает мощными щелочными свойствами и широко используется в различных отраслях науки и промышленности.
Какой состав имеет кислота натрия?
Кислота натрия (NaOH) состоит из одного атома натрия, одного атома кислорода и одного атома водорода. Она обладает мощными щелочными свойствами и широко используется в различных отраслях промышленности. Кислота натрия, также известная как едкая сода, является одной из основных составляющих бытового щелочного раствора и используется в качестве моющего средства и регулятора pH в различных процессах.
Как можно использовать кислоты щелочных металлов?
Кислоты щелочных металлов могут использоваться в различных областях. Например, кислота калия (KOH) может быть использована в процессах электролиза, производстве мыла, аккумуляторах и в медицининских препаратах. Кислота натрия (NaOH), также известная как едкая сода, применяется в производстве бумаги, мыла, стекла и различных химических процессах. Оба этих вещества обладают щелочными свойствами и находят широкое применение в различных отраслях промышленности и научных исследованиях.
