Щелочные металлы, такие как литий, натрий, калий и др., обладают специфическими химическими свойствами, включая способность образовывать кислоты при реакции с водой. Кислоты щелочных металлов представляют собой особый класс соединений, обладающих определенными химическими и физическими свойствами.
Процесс образования кислот щелочных металлов связан с реакцией между металлом и молекулой воды. В результате образуется ион гидроксида и выделяется водород. Например, реакция лития с водой приводит к образованию литиевого иона (Li+) и гидроксидиона (OH-), а также выделению водорода (H2).
Химические формулы кислот щелочных металлов выглядят следующим образом: для лития - LiOH, для натрия - NaOH, для калия - KOH и так далее. Соединения этих металлов представляют собой одноатомные ионы металла, связанные с гидроксидными группами, образующими основание.
Кислоты щелочных металлов имеют широкое применение в различных областях, включая химическую промышленность, медицину и бытовую сферу. Они используются в процессах нейтрализации, при производстве моющих средств и лекарственных препаратов, а также в процессе синтеза различных органических соединений. Кроме того, кислоты щелочных металлов являются важными компонентами электролитов, используемых в электрохимических процессах.
Информация о составе

Щелочные металлы включают в себя элементы первой группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Каждый из этих элементов обладает своим характерным химическим составом, который определяет их свойства и возможности применения.
Например, литий является самым легким искусственным металлом, обладающим высокой электроотрицательностью и способностью образовывать стабильные соединения с другими элементами. Натрий является одним из основных элементов пищи, входит в состав морской соли и используется в промышленности для производства щелочи и луга. Потребление калия необходимо для нормального функционирования организма, так как он входит в состав клеток и содействует правильному обмену веществ.
Щелочные металлы обладают схожим химическим поведением и характерным способом взаимодействия с окружающей средой. Они образуют стабильные и легко растворимые соединения с кислотами, которые называются солями. Это свойство позволяет использовать щелочные металлы в качестве реагентов и компонентов в химической промышленности, производстве удобрений, стекла, мыла, а также в ядерной энергетике.
- Литий: Li
- Натрий: Na
- Калий: K
- Рубидий: Rb
- Цезий: Cs
- Франций: Fr
Формула щелочных металлов

Щелочные металлы - это элементы первой группы периодической системы, которые в основном имеют одно электронное оболочку. Формула щелочных металлов позволяет наглядно представить состав их молекул. Все щелочные металлы отличаются отличной отнесенностью и молекулярной формулой, что объясняется различием в их химических свойствах.
Натрий, обозначенный символом Na - элемент с атомным номером 11, имеет формулу NaOH, что указывает на его присутствие в гидроксиде натрия. Калий (K) имеет формулу KOH, а мышьяк (Rb) - RbOH. Формула лития (Li) также интересна: LiOH.
Все щелочные металлы реагируют с водой, образуя соответствующие гидроксиды и приводя к образованию гидроксидов щелочных металлов. Формула этих соединений говорит о наличии одного атома металла и одного атома кислорода в молекуле. Наличие гидроксила (ОН) указывает на наличие водорода.
Интересно отметить, что формула щелочных металлов отличается от формулы кислот. В кислотах формула начинается с водорода, а в щелочных металлах - с металла. Также в кислотах на последнем месте стоит атом кислорода, в то время как в щелочных металлах на последнем месте стоит атом водорода.
Следы кислот щелочных металлов

Кислоты щелочных металлов, таких как гидроксиды натрия и калия, играют важную роль в различных сферах нашей жизни. Они широко применяются в промышленности, медицине, химической лаборатории и домашнем хозяйстве. Все эти приложения требуют аккуратного обращения с этими кислотами, поскольку даже небольшие следы могут вызвать различные проблемы.
Следы кислот щелочных металлов могут быть обнаружены на поверхностях, с которыми они контактируют. Например, на стеклянной посуде могут оставаться следы кислоты, если она не была достаточно хорошо промыта. Эти следы могут быть видимы глазом или остаться невидимыми, но их наличие может оказать негативное влияние на последующее использование посуды.
Удаление следов кислот щелочных металлов весьма важно для поддержания безопасности и качества продукции. Для этого используются различные способы, включая промывку поверхностей водой, обработку особыми химическими растворами или применение специальных абразивных средств. В лабораториях и промышленных предприятиях регулярно осуществляют контроль качества, чтобы обнаружить и устранить следы этих кислот, поскольку они могут оказать негативное влияние на результаты проводимых исследований или на производимые продукты.
Итак, следы кислот щелочных металлов представляют потенциальную опасность и требуют аккуратного обращения. Правильное удаление этих следов является важным шагом для поддержания безопасности и качества используемых поверхностей и продуктов. Это позволяет избежать негативных последствий и обеспечить эффективное функционирование в рамках промышленных процессов, медицинской диагностики, химических исследований и повседневной деятельности.
Реакции кислот щелочных металлов
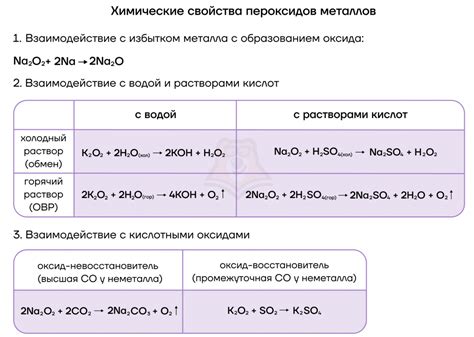
Кислоты щелочных металлов обладают особыми свойствами и способны взаимодействовать с различными веществами. Они образуют соли и воду, причем в процессе реакции происходит обмен ионами.
Реакции кислот щелочных металлов с кислородом:
- Кислоты щелочных металлов взаимодействуют с кислородом воздуха с образованием соответствующих оксидов.
- Например, щелочные металлы натрий, калий и литий образуют оксиды Na2O, K2O и Li2O соответственно.
Реакции кислот щелочных металлов с водой:
- Кислоты щелочных металлов расщепляются в воде на катионы металла и анионы гидроксида.
- Например, реакция натрия Na и воды H2O приводит к образованию гидроксида натрия NaOH и выделению водорода H2.
Реакции кислот щелочных металлов с кислотами:
- Щелочные металлы образуют соли с кислотами.
- Например, реакция натрия Na и соляной кислоты HCl приводит к образованию хлорида натрия NaCl и выделению водорода H2.
Таким образом, реакции кислот щелочных металлов важны для понимания и изучения химических свойств этих веществ. Они позволяют определить основные характеристики щелочных металлов и их взаимодействие с другими веществами.
Составные части кислот щелочных металлов

Кислоты щелочных металлов являются неорганическими соединениями, состоящими из щелочных металлов и кислорода. Главными представителями таких кислот являются гидроксиды щелочных металлов, включающие гидроксид натрия (NaOH), гидроксид калия (KOH) и гидроксид лития (LiOH).
Гидроксиды щелочных металлов обладают выраженными основными свойствами и широко применяются в различных сферах деятельности. Например, гидроксид натрия находит применение в производстве бумаги, стекла и мыла, а также используется в пищевой промышленности как регулятор pH и пищевая добавка. Гидроксид калия применяется для производства удобрений и щелочных элементов аккумуляторов, а гидроксид лития используется в производстве прозрачных проводящих пленок.
Кроме гидроксидов, в составе кислот щелочных металлов могут присутствовать соли этих металлов. Например, к кислородосодержащим кислотам натрия и калия относятся соли, такие как нитрат натрия (NaNO3) и нитрат калия (KNO3). Эти соли широко используются в сельском хозяйстве в качестве удобрений.
Таким образом, составные части кислот щелочных металлов включают гидроксиды и соли этих металлов. Эти соединения имеют разнообразные применения в различных областях промышленности и сельского хозяйства, а также в повседневной жизни.
Применение кислот щелочных металлов

Кислоты щелочных металлов широко применяются в различных отраслях промышленности и научных исследованиях. Они являются важными химическими реагентами и используются в множестве процессов.
Анодные процессы и электролиз: Кислоты щелочных металлов часто используются в анодных процессах и электролизе. Они служат источниками водорода и окислителя для реакций, проводимых в электролитических ячейках. Например, гидроксид натрия (щелочная сода) используется в процессах хлорирования и производства алюминия.
Химическая промышленность: Кислоты щелочных металлов широко применяются в химической промышленности. Они используются в процессах синтеза органических и неорганических веществ, а также в качестве растворителей и катализаторов. Одним из примеров такого применения является использование гидроксида калия в процессе синтеза калийных солей, которые затем используются в производстве стекла, мыла и многочисленных химических соединений.
Утилизация отходов: Кислоты щелочных металлов играют важную роль в процессе утилизации отходов. Например, гидроксид натрия используется для нейтрализации и обезвреживания опасных отходов, таких как кислотные растворы и пестициды. В результате реакции с щелочью, опасные вещества становятся менее активными и безопасными для окружающей среды.
В целом, кислоты щелочных металлов играют важную роль в многих областях промышленности и науки, способствуя развитию и оптимизации процессов, улучшению качества продукции и снижению негативного влияния на окружающую среду.
Вопрос-ответ

Что такое щелочные металлы?
Щелочные металлы - это элементы периодической системы химических элементов, которые находятся в первой группе.
Каков состав кислот щелочных металлов?
Кислота щелочных металлов образуется в результате реакции между щелочным металлом и водой. Ее формула обычно имеет вид MOH, где M - металл. Например, калиевая гидроксидная (каустическая) щелочь имеет формулу KOH, литиевая - LiOH, натриевая - NaOH, рубидиевая - RbOH, цезиевая - CsOH.
Какую роль играют щелочные металлы в кислотах?
Щелочные металлы являются основаниями, образуящими кислоты. Они обладают высокой щелочностью и растворяются в воде, ионизируясь и образуя гидроксидные ионы (OH-). Эти ионы являются основным компонентом кислот щелочных металлов.
Можно ли использовать щелочные металлы для приготовления кислот дома?
Щелочные металлы могут использоваться для приготовления кислот в лаборатории, но из-за их высокой реактивности и опасности использования, не рекомендуется проводить такие эксперименты дома без специальных знаний и оборудования.
Какую практическую значимость имеют кислоты щелочных металлов?
Кислоты щелочных металлов находят широкое применение в различных отраслях промышленности и научных исследованиях. Они используются в производстве мыла, стекла, химических удобрений, алкоголя, пищевых добавок и других продуктов.
