Щелочные металлы – это группа химических элементов, которая находится в первой группе периодической системы. Они составляют основу различных минералов и обладают уникальными свойствами. Щелочные металлы включают литий, натрий, калий, рубидий, цезий и франций.
Одной из главных особенностей щелочных металлов является их высокая реактивность. Они легко реагируют с кислородом и водой, выделяя большое количество тепла. Также они способны взаимодействовать с другими элементами и соединениями, что делает их полезными в различных отраслях промышленности и науке.
Щелочные металлы обладают низкой плотностью и низкой температурой плавления. Они имеют мягкую и гладкую текстуру, что облегчает их обработку. Благодаря своим физическим свойствам, они находят широкое применение в производстве сплавов, электродов, аккумуляторов и других изделий.
Исследование и изучение щелочных металлов являются важными задачами современной науки. Они представляют интерес для ученых и исследователей, так как могут применяться в различных сферах, включая энергетику, медицину и нанотехнологии. Кроме того, щелочные металлы имеют большое значение для понимания основных принципов химии и физики.
Что такое щелочные металлы и их значение

Щелочные металлы - это группа химических элементов, которые расположены в первой группе периодической системы. К этой группе относятся литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr). Они обладают низкой плотностью и низкой температурой плавления.
Щелочные металлы имеют ряд характерных особенностей. Их окислительные свойства делают их хорошими веществами для производства взрывчатых веществ. Они реагируют с водой, образуя щелочи, что делает их полезными в различных отраслях, включая производство мыла и стекла. Щелочные металлы также используются в батареях, электрических проводах и других электрохимических устройствах.
Важное значение щелочных металлов проявляется в их участии в биологических процессах. Они являются необходимыми макроэлементами для жизнедеятельности организмов и выполняют важные функции в клетке. Например, калий регулирует внутриклеточное равновесие, а натрий - участвует в передаче нервных импульсов.
Однако неконтролируемое потребление щелочных металлов может быть опасным для организма. Избыток калия может привести к сердечным аритмиям, а натрия - к повышению давления. Поэтому важно соблюдать баланс их потребления и обращаться к врачу при необходимости.
Химические свойства

Щелочные металлы – это высокоактивные элементы, которые обладают отличными химическими свойствами.
Первое химическое свойство щелочных металлов – способность быстро реагировать с водой. Реакция проходит с выделением водорода и образованием щелочного раствора. Например, литий, наименее активный из щелочных металлов, реагирует с водой медленно, в то время как цезий, самый активный металл, реагирует с водой взрывообразно.
Второе химическое свойство связано с реакцией щелочных металлов с кислородом. Щелочные металлы реагируют с кислородом из воздуха, образуя окислы. Например, натрий при взаимодействии с воздухом покрывается оксидом натрия, который имеет белый цвет.
Третье химическое свойство – способность щелочных металлов образовывать щелочные оксиды и гидроксиды. Гидроксиды щелочных металлов (щелочи) широко используются в химической промышленности и в быту.
Еще одно химическое свойство щелочных металлов – способность образовывать соли. Они могут вступать в реакцию с различными кислотами и образовывать соли. Например, натрий реагирует с соляной кислотой и образует хлорид натрия, а литий – с серной кислотой и образует сульфат лития.
Также щелочные металлы имеют способность образовывать сплавы с многими другими элементами. Эти сплавы обладают различными полезными свойствами и широко применяются в различных отраслях промышленности.
Реактивность щелочных металлов
Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются наиболее реактивными элементами в периодической таблице. Это связано с их электрохимическими свойствами и низкой энергией ионизации.
Реактивность щелочных металлов проявляется в их способности с легкостью образовывать положительные ионы, которые активно реагируют с другими веществами. Например, они с легкостью реагируют с кислородом воздуха, образуя оксиды металлов и едкие щелочные гидроксиды.
Кроме того, щелочные металлы реагируют с водой, образуя щелочные гидроксиды и выделяя водород. Реакция с водой становится все более интенсивной при увеличении атомного номера элемента. Например, литий реагирует с водой медленно, а калий реагирует очень быстро и даже может вызывать возгорание газов, выделяющихся при реакции.
Также стоит отметить, что щелочные металлы реагируют с некоторыми неметаллами, такими как хлор, бром и йод. Эти реакции приводят к образованию солей щелочных металлов.
Суммируя все вышеуказанное, можно сказать, что реактивность щелочных металлов является одной из основных характеристик этих элементов, и она определяется их химической активностью и энергией ионизации.
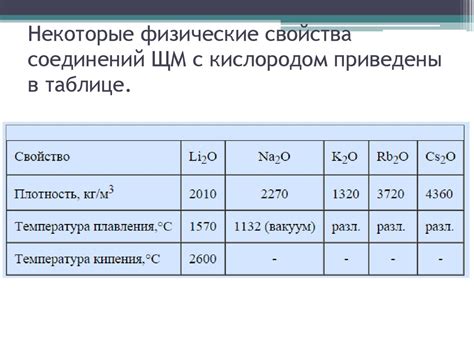
Физические свойства

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, обладают рядом уникальных физических свойств.
Во-первых, они являются мягкими и легкими металлами, что делает их удобными для использования в промышленности и в научных исследованиях. Мягкость этих металлов объясняется их слабой взаимной связью атомов.
Во-вторых, щелочные металлы обладают низкой плотностью, что означает, что они легче других металлов и могут быть использованы для создания легких конструкций.
Также стоит отметить, что щелочные металлы имеют низкую температуру плавления и кипения, что делает их легко перегреваемыми и использованием в высокотемпературных процессах.
Еще одной уникальной физической особенностью щелочных металлов является их реакция с воздухом и водой. Они быстро окисляются и реагируют с водой, образуя щелочные растворы и выделяя водородный газ.
Наконец, щелочные металлы обладают высокой электропроводностью, что делает их незаменимыми в производстве аккумуляторов, электродов и других электронных устройств.
Температура плавления и кипения щелочных металлов

Щелочные металлы, такие как литий, натрий, калий и др., имеют низкую температуру плавления и кипения. Это связано с особенностями их атомной структуры и химическими свойствами.
Литий - легкий металл с атомным номером 3, имеет самую низкую температуру плавления из всех щелочных металлов. Его температура плавления составляет около 180 градусов Цельсия. Это позволяет литию быть использованным в различных областях, включая применение в легких конструкциях и аккумуляторах.
Натрий, имеющий атомный номер 11, имеет температуру плавления около 97 градусов Цельсия. Это делает натрий одним из наиболее доступных щелочных металлов для использования в различных промышленных процессах, включая производство стекла, мыла и стружки.
Калий, с атомным номером 19, имеет температуру плавления около 64 градусов Цельсия. Это позволяет его использование в широком спектре применений, включая производство удобрений, взрывчатых веществ и лекарственных препаратов.
Температура кипения щелочных металлов также невысока. Например, у калия она составляет около 774 градуса Цельсия. Эта низкая температура кипения обусловлена малой величиной межатомных сил у щелочных металлов, что делает их легкими для испарения и возможности использования в различных технологических процессах.
Таким образом, щелочные металлы обладают низкой температурой плавления и кипения, что делает их уникальными материалами с широким спектром применений в различных отраслях промышленности и науки.
Применение

Щелочные металлы находят широкое применение в различных отраслях науки и техники.
Калий в основном применяется в сельском хозяйстве как удобрение для повышения плодородия почвы. Он также используется в производстве стекла, мыла, химических удобрений, взрывчатых веществ и лекарственных препаратов. Калийные соли находят применение в пищевой промышленности как пищевые добавки.
Натрий обладает высокой реакционной способностью, поэтому находит применение в производстве щелочей и веществ, используемых для чистки и дезинфекции поверхностей. Натрий также используется в производстве стекла, мыла, пищевых добавок, а также в обработке металлов и производстве аккумуляторов.
Литий является основным материалом для производства литий-ионных аккумуляторов, которые широко применяются в мобильных устройствах, электромобилях и портативных электронных устройствах. Литий также используется в производстве лекарственных препаратов, стекла и керамики. В ядерной энергетике литий используется для производства тепловыделяющих элементов.
Цезий имеет применение в атомной энергетике и исследовательских лабораториях, где его используют в качестве радиоактивного источника. Он также используется для производства фотокатодов в научной аппаратуре и ламп низкого давления. Кроме того, цезий имеет применение в электронике и оптике, а также в производстве часов и контрольных приборов.
Использование щелочных металлов в промышленности

Щелочные металлы, такие как литий, натрий, калий, рубидий и цезий, являются важными ресурсами в промышленности благодаря своим уникальным свойствам.
Литий широко используется в производстве литиевых ионных батарей, которые используются в электронике, электромобилях и хранении энергии. Он также применяется в производстве лекарств, лазеров и стекол.
Натрий является одним из основных компонентов пищевых добавок и солей. Он также используется в производстве щелочных элементов и жидкого натрия, которые применяются в промышленности атомной энергетики и химической промышленности.
Калий является необходимым элементом для растений, поэтому он широко используется в сельском хозяйстве, в том числе в производстве удобрений. Он также используется в производстве стекла, мыла и моющих средств.
Рубидий и цезий применяются в оптоэлектронике, солнечных батареях и атомных часах. Они также используются в научных исследованиях, в производстве стекла, лазеров и катализаторов.
Щелочные металлы играют важную роль в современной промышленности, обеспечивая энергетические и химические ресурсы, которые необходимы для различных отраслей и процессов производства.
Биологическая роль

Щелочные металлы имеют высокую биологическую активность и существенно влияют на обмен веществ организма. Они являются необходимыми элементами для нормального функционирования клеток и тканей.
Калий, распространенный щелочный металл, существенен для работы мышц, особенно сердечной мышцы. Калий помогает поддерживать нормальное давление и регулирует баланс воды в организме.
Натрий, также являющийся щелочным металлом, играет важную роль в поддержании кислотно-щелочного баланса. Он контролирует уровень воды в клетках и тканях организма, а также участвует в передаче нервных импульсов.
Литий, хотя и не является необходимым элементом для организма, тем не менее, имеет некоторую биологическую роль. Литий используется в лечении некоторых психических расстройств, таких как биполярное аффективное расстройство и маниакально-депрессивное психоз.
Однако, несмотря на полезность щелочных металлов в организме, их переизбыток или недостаток может привести к различным заболеваниям. Поддержание правильного баланса этих элементов в организме является важной составляющей здорового образа жизни.
Влияние щелочных металлов на организм человека

Щелочные металлы, такие как литий, натрий, калий и другие, играют важную роль в жизнедеятельности организма человека. Они участвуют в множестве биохимических процессов и регулируют нормальное функционирование органов и систем.
Одним из основных влияний щелочных металлов на организм является участие в регуляции водного и электролитного баланса. Натрий, калий и другие щелочные металлы играют важную роль в поддержании оптимального уровня воды и электролитов в организме. Они помогают поддерживать стабильное давление и обеспечивать нормальную работу сердечно-сосудистой системы.
Кроме того, щелочные металлы участвуют в передаче нервных импульсов и синтезе гормонов. Литий, например, имеет антиманиакальное действие и применяется в лечении некоторых психических расстройств. Калий необходим для сокращения мышц и поддержания нормальной функции сердца.
Однако, важно помнить, что употребление щелочных металлов должно быть умеренным. Их избыток или недостаток может вызвать различные проблемы со здоровьем. Повышенное потребление натрия, на пример, может способствовать развитию гипертонии и других сердечно-сосудистых заболеваний. С другой стороны, недостаток калия может привести к мышечным судорогам и нарушению сердечного ритма. Поэтому важно соблюдать баланс и употреблять щелочные металлы в разумных количествах.
В целом, щелочные металлы являются важным элементом питания и оказывают значительное влияние на организм человека. Они необходимы для нормального функционирования органов и систем, их недостаток или избыток может вызвать различные проблемы со здоровьем. Поэтому рациональное и сбалансированное питание, включающее в себя щелочные металлы, является ключом к поддержанию здоровья и благополучия.
Вопрос-ответ

Какие металлы относятся к щелочным?
Щелочными металлами являются литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs) и франций (Fr).
Какие особенности имеют щелочные металлы?
У щелочных металлов есть несколько особенностей. Они очень реактивны и активно взаимодействуют с кислородом в воздухе. Также они мягкие и имеют низкую температуру плавления. Щелочные металлы обладают высокой электропроводностью и образуют ионы положительного заряда.
Какие применения имеют щелочные металлы?
Щелочные металлы имеют широкий спектр применений. Например, литий используется в производстве аккумуляторов, натрий используется в пищевой и фармацевтической промышленности, калий используется в сельском хозяйстве, рубидий используется в лазерной технологии, цезий используется в атомных часах.
Какие опасности связаны с использованием щелочных металлов?
Щелочные металлы имеют ряд опасностей. Они реагируют с водой, образуя взрывоопасные газы. При взаимодействии с кислородом в воздухе могут возникать пожары. Также они могут вызывать ожоги на коже и раздражение глаз. Поэтому при работе с щелочными металлами необходимо соблюдать меры предосторожности и работать в специальных защитных средствах.
